10.13: Avogadro’s Hypothese en Molair Volume
Avogadro’s Hypothese en Molair Volume
Hoeveelheid is een derde manier om de hoeveelheid materie te meten, na het aantal voorwerpen en massa. Bij vloeistoffen en vaste stoffen varieert het volume sterk, afhankelijk van de dichtheid van de stof. Dit komt doordat vaste en vloeibare deeltjes dicht op elkaar gepakt zitten met heel weinig ruimte tussen de deeltjes. Gassen bestaan echter grotendeels uit lege ruimtes tussen de eigenlijke gasdeeltjes (zie onderstaande figuur).
In 1811 verklaarde Amadeo Avogadro dat de volumes van alle gassen gemakkelijk kunnen worden bepaald. Avogadro’s hypothese stelt dat gelijke volumes van alle gassen bij dezelfde temperatuur en druk gelijke aantallen deeltjes bevatten. Aangezien het totale volume dat een gas inneemt hoofdzakelijk bestaat uit de lege ruimte tussen de deeltjes, is de werkelijke grootte van de deeltjes zelf bijna verwaarloosbaar. Een bepaald volume van een gas met kleine lichte deeltjes zoals waterstof bevat evenveel deeltjes als hetzelfde volume van een zwaar gas met grote deeltjes zoals zwavelhexafluoride
Gassen zijn samendrukbaar, dat wil zeggen dat wanneer ze onder hoge druk worden gezet, de deeltjes dichter naar elkaar toe worden geperst. Hierdoor neemt de hoeveelheid lege ruimte af en neemt het volume van het gas af. Het gasvolume wordt ook beïnvloed door de temperatuur. Wanneer een gas wordt verwarmd, bewegen de moleculen sneller en zet het gas uit. Vanwege de variatie in gasvolume als gevolg van druk- en temperatuursveranderingen, moet de vergelijking van gasvolumes worden gedaan bij één standaardtemperatuur en -druk. De standaardtemperatuur en -druk (STP) is gedefinieerd als 0 ^(0 ^text{o} \C}) \(273,15 \: \text{K} \rechts)\) en 1 \(1 \: \atm} \) druk. Het molaire volume van een gas is het volume van één mol van een gas bij STP. Bij STP heeft een mol (6,02 maal 10^{23}) representatieve deeltjes) van een gas een volume van 22,4 liter (figuur hieronder).

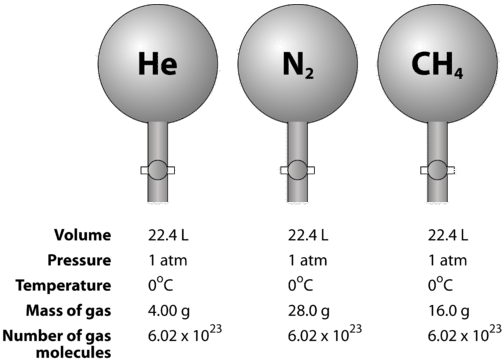
De onderstaande figuur illustreert hoe het molaire volume kan worden gezien bij het vergelijken van verschillende gassen. De gassen helium (links), stikstof (links), en methaan (links) zijn bij STP. Elk bevat 1 mol of 6,02 maal 1023 deeltjes. De massa van elk gas is echter anders en komt overeen met de molaire massa van dat gas: \4,00 voor He, 28,0 voor N2 en 16,0 voor CH4.