19.1: Polypeptides and Proteins
Learning Objectives
- Define or describe the following:
- amino acid
- “R” group
- peptide bond
- peptide
- polypeptide
- primary protein structure
- secondary protein structure
- tertiary protein structure
- quaternary protein structure
- gene
- Describe how the primary structure of a protein or polypeptide ultimately detemines its final three-dimensional shape.
- Describe how the order of nucleotide bases in DNA ultimately determines the final three-dimensional shape of a protein or polypeptide.
Amino acids are the building blocks for proteins. All amino acids contain an amino or NH2 group and a carboxyl (acid) or COOH group. There are 20 different amino acids commonly found in proteins and often 300 or more amino acids per protein molecule. Elk aminozuur verschilt in termen van zijn “R”-groep. De “R”-groep van een aminozuur is de rest van het molecuul, dat wil zeggen, het gedeelte buiten de aminogroep, de zuurgroep, en de centrale koolstof. Elk verschillend aminozuur heeft een unieke “R”-groep en de unieke chemische eigenschappen van een aminozuur hangen af van die van zijn “R”-groep (Figuur \PageIndex{1}).
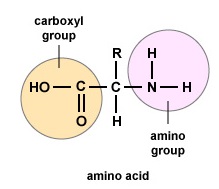
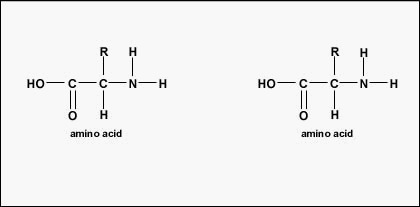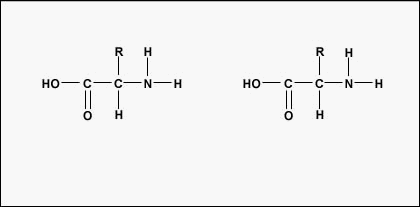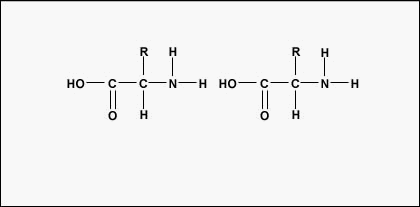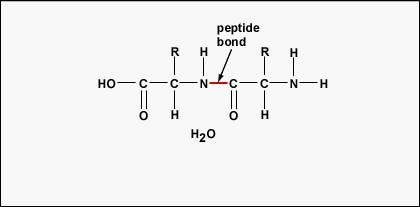
Om polypeptiden en proteïnen te vormen, worden aminozuren met elkaar verbonden door peptidebindingen, waarbij de amino- of NH2-groep van het ene aminozuur bindt aan de carboxyl(zuur)- of COOH-groep van een ander aminozuur, zoals te zien is in (figuur \(\PageIndex{2}\) en figuur \(\PageIndex{3}\)).
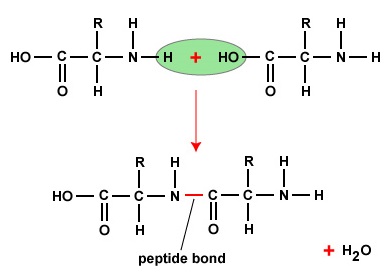
Een peptide zijn twee of meer aminozuren die door peptidebindingen aan elkaar zijn gebonden, en een polypeptide is een keten van veel aminozuren. Een eiwit bevat een of meer polypeptiden. Daarom zijn eiwitten lange ketens van aminozuren die bij elkaar worden gehouden door peptidebindingen.
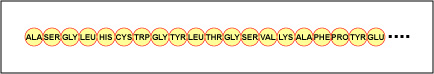
De feitelijke volgorde van de aminozuren in het eiwit wordt de primaire structuur genoemd (figuur \PageIndex{4}\) en wordt bepaald door het DNA. Zoals we later in dit onderdeel zullen zien, is DNA verdeeld in functionele eenheden die genen worden genoemd. Een gen is een sequentie van desoxyribonucleotidebasen langs één streng DNA die codeert voor een functioneel product – een specifieke molecule van boodschapper-RNA, transfer-RNA, of ribosomaal RNA. Het product is meestal boodschapper-RNA (mRNA) en mRNA resulteert uiteindelijk in de synthese van een polypeptide of een eiwit. Daarom wordt gewoonlijk gezegd dat de volgorde van de desoxyribonucleotidebasen in een gen bepalend is voor de aminozuursequentie van een bepaald eiwit. Aangezien bepaalde aminozuren kunnen interageren met andere aminozuren in hetzelfde eiwit, bepaalt deze primaire structuur uiteindelijk de uiteindelijke vorm en daarmee de chemische en fysische eigenschappen van het eiwit.
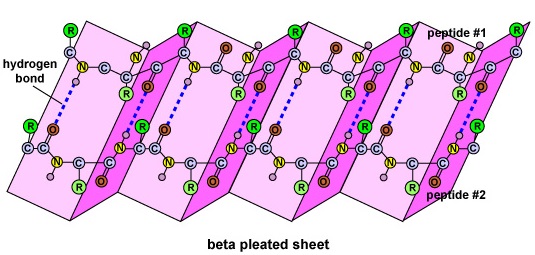
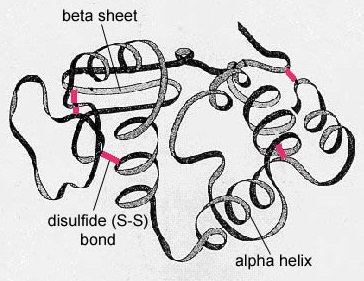
De secundaire structuur van het eiwit is het gevolg van waterstofbruggen die zich vormen tussen het zuurstofatoom van een aminozuur en het stikstofatoom van een ander. Hierdoor krijgt het eiwit of polypeptide de tweedimensionale vorm van een alfa-helix of een bèta-geplooide plaat (figuur
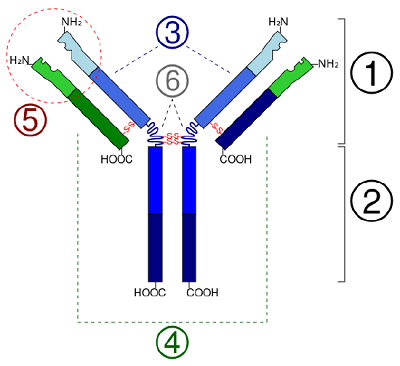
In bolvormige eiwitten, zoals enzymen, wordt de lange keten aminozuren opgevouwen tot een driedimensionale functionele vorm of tertiaire structuur. Dit komt doordat bepaalde aminozuren met sulfhydryl- of SH-groepen disulfidebindingen (S-S) vormen met andere aminozuren in dezelfde keten. Andere interacties tussen R-groepen van aminozuren zoals waterstofbruggen, ionische bindingen, covalente bindingen, en hydrofobe interacties dragen ook bij aan de tertiaire structuur (figuur). In sommige eiwitten, zoals antilichaummoleculen en hemoglobine, kunnen meerdere polypeptiden aan elkaar hechten om een quaternaire structuur te vormen (figuur
Zoals later in deze unit zal blijken, wordt tijdens de eiwitsynthese de volgorde van de nucleotidebasen langs een gen getranscribeerd in een complementaire streng mRNA, die vervolgens door tRNA wordt vertaald in de juiste volgorde van aminozuren voor dat polypeptide of eiwit. Daarom bepaalt de volgorde van de desoxyribonucleotidebasen langs het DNA de volgorde van de aminozuren in de proteïnen. Omdat bepaalde aminozuren kunnen interageren met andere aminozuren, bepaalt de volgorde van aminozuren voor elk eiwit zijn uiteindelijke driedimensionale vorm, die op zijn beurt de functie van dat eiwit bepaalt (b.v, met welk substraat een enzym zal reageren, met welke epitopen de Fab van een antilichaam zal combineren, aan welke receptoren een cytokine zich zal binden).
Samenvatting
- Aminozuren zijn de bouwstenen voor eiwitten. Er zijn 20 verschillende aminozuren die gewoonlijk in eiwitten voorkomen en vaak 300 of meer aminozuren per eiwitmolecuul.
- Alle aminozuren bevatten een amino- of NH2-groep en een carboxyl- (zuur) of COOH-groep.
- Om polypeptiden en proteïnen te vormen, worden aminozuren samengevoegd door peptidebindingen, waarbij de amino- of NH2-groep van het ene aminozuur bindt aan de carboxyl- (zuur) of COOH-groep van een ander aminozuur.
- Een peptide zijn twee of meer aminozuren die door peptidebindingen aan elkaar zijn verbonden; een polypeptide is een keten van vele aminozuren; en een proteïne bevat een of meer polypeptiden. Daarom zijn proteïnen lange ketens van aminozuren die bij elkaar worden gehouden door peptidebindingen.
- De feitelijke volgorde van de aminozuren in het proteïne wordt de primaire structuur genoemd en wordt bepaald door DNA.
- De volgorde van de desoxyribonucleotide basen in een gen bepaalt de aminozuurvolgorde van een bepaald proteïne. Aangezien bepaalde aminozuren kunnen interageren met andere aminozuren in hetzelfde eiwit, bepaalt deze primaire structuur uiteindelijk de uiteindelijke vorm en daarmee de chemische en fysische eigenschappen van het eiwit.
- De secundaire structuur van het eiwit is het gevolg van waterstofbruggen die zich vormen tussen het zuurstofatoom van het ene aminozuur en het stikstofatoom van een ander en geeft het eiwit of polypeptide de tweedimensionale vorm van een alfa-helix of een beta-geplooide plaat.
- In bolvormige eiwitten, zoals enzymen, wordt de lange keten van aminozuren gevouwen tot een driedimensionale functionele vorm of tertiaire structuur. Dit komt doordat bepaalde aminozuren met sulfhydryl- of SH-groepen disulfidebindingen (S-S) vormen met andere aminozuren in dezelfde keten. Andere interacties tussen R-groepen van aminozuren, zoals waterstofbruggen, ionische bindingen, covalente bindingen, en hydrofobe interacties dragen ook bij aan de tertiaire structuur.
- In some proteins, such as antibody molecules, several polypeptides may bond together to form a quaternary structure.
Contributors and Attributions
-
Dr. Gary Kaiser (COMMUNITY COLLEGE OF BALTIMORE COUNTY, CATONSVILLE CAMPUS)