4. Sterke en zwakke basen
Zwakke basen
Ammoniak is een typische zwakke base. Ammoniak zelf bevat natuurlijk geen hydroxide-ionen, maar het reageert met water tot ammoniumionen en hydroxide-ionen.
De reactie is echter omkeerbaar, en op elk moment is ongeveer 99% van de ammoniak nog aanwezig als ammoniakmoleculen. Slechts ongeveer 1% heeft daadwerkelijk hydroxide-ionen gevormd. Een zwakke base is een base die in oplossing niet volledig in hydroxide-ionen wordt omgezet. Wanneer een zwakke base met water reageert, varieert de evenwichtspositie van base tot base. Hoe verder naar links, hoe zwakker de base.
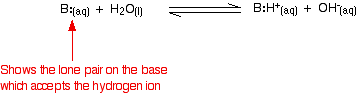
Je kunt de positie van een evenwicht meten door een evenwichtsconstante voor de reactie te schrijven. Hoe lager de waarde van de constante, hoe meer het evenwicht naar links ligt. In dit geval wordt de evenwichtsconstante Kb genoemd. Deze is gedefinieerd als:
\}{}\]
The relationship between Kb and pKb is exactly the same as all the other “p” terms in this topic:
\
The table shows some values for \(K_b\) and \(pK_b\) for some weak bases.
| base | Kb (mol dm-3) | pKb |
|---|---|---|
| C6H5NH2 | 4.17 x 10-10 | 9.38 |
| NH3 | 1.78 x 10-5 | 4.75 |
| CH3NH2 | 4.37 x 10-4 | 3.36 |
| CH3CH2NH2 | 5.37 x 10-4 | 3.27 |