Adipocyten
Adipocyten zijn de belangrijkste opslagplaatsen voor energie in het lichaam, en ze hebben ook belangrijke endocriene functies. Daarom is inzicht in de ontwikkeling en functie van adipocyten – met name in het licht van de obesitas-pandemie – van essentieel belang om de metabole homeostase te begrijpen. Er zijn twee algemene klassen van adipocyten; witte adipocyten – die energie opslaan als een enkele grote lipidedruppel en belangrijke endocriene functies hebben, en bruine adipocyten – die energie opslaan in meerdere kleine lipidedruppels, maar specifiek voor gebruik als brandstof om lichaamswarmte te genereren (d.w.z. thermogenese). Warmteproductie door bruine adipocyten wordt mogelijk gemaakt door hun unieke expressie van mitochondriaal gelokaliseerd uncoupling protein 1 (Ucp1). Deze classificaties zijn echter overgesimplificeerd omdat sommige witte adipocyten bruine adipocyte karakteristieken kunnen aannemen (brite of beige adipocyten genoemd) en vice versa, afhankelijk van de temperatuur en het dieet. Wij zijn geïnteresseerd in het begrijpen van de oorsprong van verschillende adipocyten en in het definiëren van de signalerings- en metabolische routes die hun ontwikkeling, distributie en functie controleren.
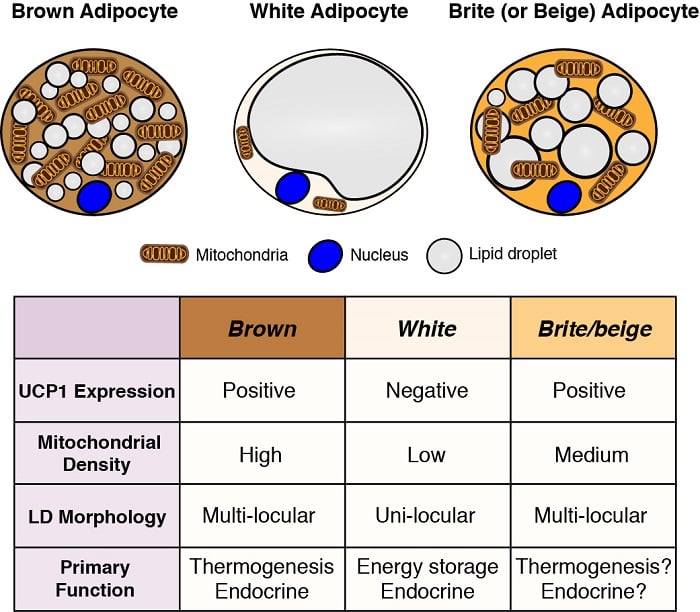
Aanzet van adipocyten
Voor een goed begrip van de rol van vetweefsel in gezondheid en ziekte is het van cruciaal belang te begrijpen hoe het groeit, en in dit opzicht is de ontwikkelingsoorsprong van verschillende typen adipocyten een van de minst begrepen gebieden van de vetweefselbiologie. Het bepalen van de oorsprong van adipocyten kan helpen bij het verklaren van de verdeling van menselijke lichaamsvetten, met name bij zwaarlijvige of lipodystrofische personen, en het kan aanwijzingen geven voor metabolische verschillen die tussen sommige vetdepots worden waargenomen. Het identificeren van adipocyte voorlopercellen en de mechanismen die hun expansie reguleren is ook van cruciaal belang voor het begrijpen en beheren van een gezonde functie van vetweefsel. Het is misschien ook mogelijk om de ontwikkeling van “gezonde” adipocyten (zoals bruine of bruine/beige adipocyten) uit voorlopercellen te ontwikkelen voor celtherapieën die er hoofdzakelijk op gericht zijn vet met vet te bestrijden. Met behulp van een combinatie van genetica en lineage-tracing strategieën hebben wij eerder de oorsprong in kaart gebracht van adipocyten die zich in verschillende depots bevinden. Onze resultaten onthullen een onverwacht niveau van heterogeniteit die consistent is met adipocyten met meerdere ontwikkelingsoorsprong en die een model ondersteunt waarin het lot van adipocyten waarschijnlijk afhangt van zowel extrinsieke als intrinsieke factoren.
Adipocyten hebben meerdere ontwikkelingsoorzaken
(linksonder) Anatomische verdeling van vetweefseldepots in een muis. Bruin vetweefsel (BAT) en wit vetweefsel (WAT) depots worden getoond. (rechtsonder) Een voorbeeld van een lineage tracing experiment waarbij ontwikkelingsvoorlopercellen en al hun afstammelingen onuitwisbaar werden gelabeld met een fluorescent merkteken gekoppeld aan expressie van Myf5 (paneel a) of Pax3 (paneel b). Groen gemerkte adipocyten (mGFP) zijn afkomstig van een andere voorlopercel dan de rood gemerkte adipocyten (mTFP).
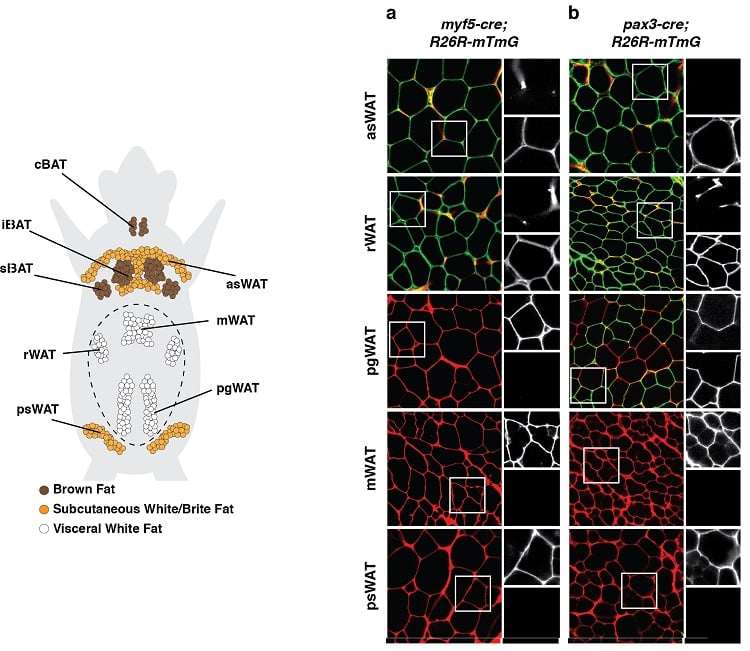
Resultaten zoals deze suggereren dat adipocyten een meervoudige ontwikkelingsoorsprong hebben.
(aangepast van Sanchez-Gurmaches & Guertin, Nature Communications 2014; Sanchez-Gurmaches et al., Trends in Cell Biology 2016)
Bruine adipocyten
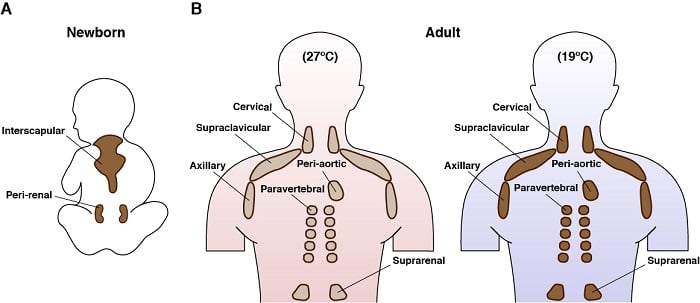
Bruine adipocyten zijn fascinerende cellen. Ze bestaan alleen bij zoogdieren, en hun belangrijkste functie is het genereren van endogene warmte in een proces dat thermogenese wordt genoemd. Dit wordt mogelijk gemaakt door hun unieke expressie van een mitochondriaal membraaneiwit genaamd uncoupling protein 1 (UCP1). De energieleverende eigenschappen van bruin vet, en de recente vaststelling dat volwassen mensen bruin vet hebben, heeft van bruin vet een doelwit gemaakt voor therapieën die gericht zijn op de bestrijding van overvoeding. Actieve bruine adipocyten hebben ook een van de meest intrigerende metabolische programma’s: ze nemen grote hoeveelheden verschillende voedingsstoffen tegelijk op en verbruiken ze ook (b.v. glucose, lipiden, aminozuren) en kunnen gelijktijdig zowel een anabool als een katabool metabolisme in werking zetten. Wij en anderen hebben bijvoorbeeld eerder aangetoond dat door koude gestimuleerde BBT een genetisch programma upreguleert dat naast vetzuuroxidatie ook de novo lipidensynthese ondersteunt. Wij willen graag meer te weten komen over dit opmerkelijke en paradoxale metabolisme.
Lees meer over de ontwikkeling en het metabolisme van bruin vetweefsel
Anatomische locatie van bruin vet bij de mens
We gebruiken ook genetische modellen om te onderzoeken hoe signaalwegen het BAT-metabolisme sturen. Met muizen hebben we bijvoorbeeld Rictor – dat codeert voor een uniek en essentieel onderdeel van mTORC2 – genetisch verwijderd, maar alleen in bruin vetweefsel. Meer informatie over mTORC2. Opmerkelijk is dat deze muizen beschermd zijn tegen een vetrijk dieet. Meer specifiek, muizen zonder BAT Rictor stapelden geen overmatige lipiden op in hun lever of viscerale vetweefseldepots wanneer ze het vetrijke dieet aten. Dit is een opwindende bevinding, aangezien een overmatige opslag van lipiden op deze plaatsen gevaarlijk ongezond is. Met behulp van een combinatie van genetica, genomica, metabolomica en biochemie proberen we te begrijpen waarom deze muizen beschermd zijn tegen een vetrijk dieet.
Witte adipocyten
Witte adipocyten zijn de meest voorkomende adipocyten bij de mens. Witte vetweefsel depots hebben ook een opmerkelijk vermogen om uit te breiden en energie op te slaan, en ze geven signalen naar de hersenen en andere weefsels om het eetgedrag en de metabole homeostase sterk te beïnvloeden. Hoewel witte vetcellen specifiek zijn aangepast om overtollige voedingsstoffen veilig op te sluiten, hebben zij echter een omslagpunt (bijv. bij obesitas) waarbij hun nuttige functies falen, en dit bevordert sterk het ontstaan van stofwisselingsziekten en type 2 diabetes. Wat bepaalt het omslagpunt? Hoe geven witte adipocyten signalen af aan andere weefsels? Hoe heterogeen zijn witte vetweefsel depots? Waarom is een teveel aan visceraal vet schadelijker voor de gezondheid dan een teveel aan onderhuids vet? Dit zijn allemaal openstaande vragen waarin wij geïnteresseerd zijn.
We bestuderen ook mTOR-signalering in witte adipocyten. mTOR is een belangrijk stroomafwaarts doelwit van insulinesignalering, het belangrijkste hormoon waar adipocyten op reageren. Met behulp van genetische muismodellen hebben we selectief ofwel mTORC1 ofwel mTORC2 geremd in alle adipocyten. Remming van mTORC1 in wit vetweefsel veroorzaakt een lipodystrofie-achtig syndroom dat gepaard gaat met insulineresistentie en vette leverziekte. Remming van mTORC2 in wit vetweefsel veroorzaakt ook insulineresistentie, maar onafhankelijk van veranderingen in vetweefselmassa. In dit laatste model lijkt mTORC2 een van de adipocyten afkomstig signaal te reguleren dat communiceert met de lever om de leverglucoseproductie te controleren. Inzicht in de mechanistische basis van deze fenotypes zal belangrijke informatie opleveren over hoe nutriëntsensitieve signaaltransductie pathways bijdragen tot de pathogenese van vetweefsel-gerelateerde ziekten.
Model van mTORC2 signalering in een witte adipocyt
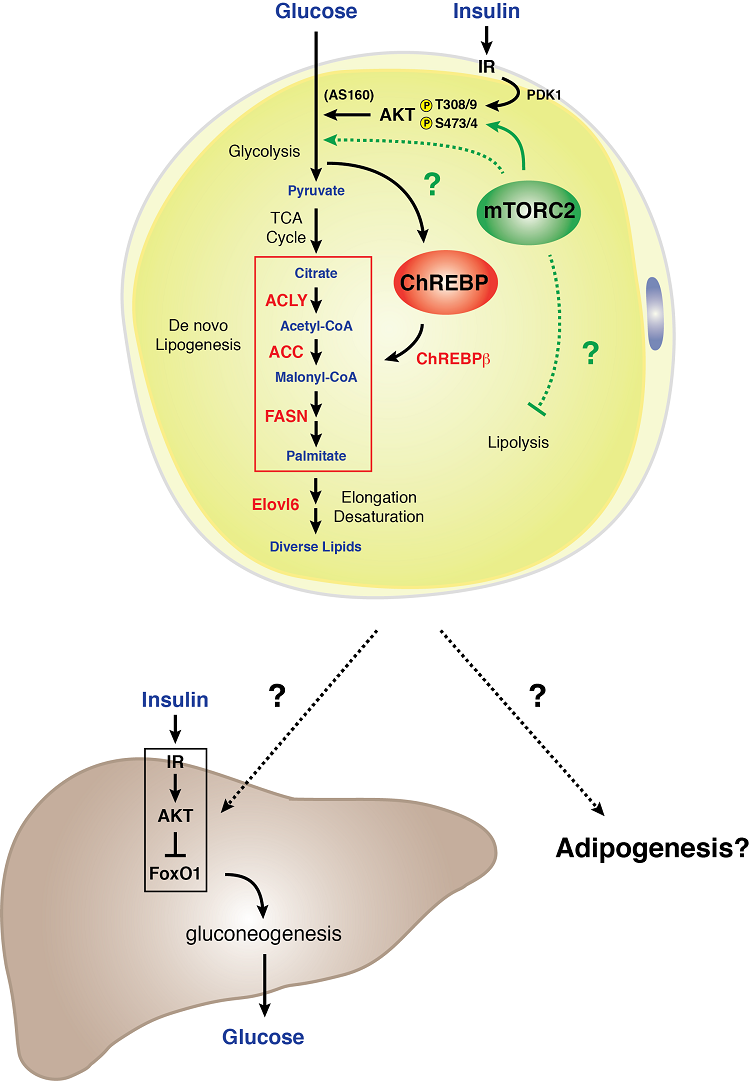 Witte adipocyten hebben mTORC2 nodig voor een normaal koolhydraat- en lipidenmetabolisme. We hebben ontdekt dat genetisch verlies van Rictor (mTORC2) specifiek in witte adipocyten de glucose-opname vermindert en de expressie van de ChREBP-beta transcriptiefactor en zijn downstream targets – waaronder de enzymen die functioneren in de de novo lipogenese pathway – vermindert. Bovendien leidt een mTORC2-deficiëntie in witte vetcellen tot ernstige leverinsulineresistentie. Deze gegevens wijzen erop dat mTORC2 in witte vetcellen een essentiële regulator is van het koolhydraat- en lipidenmetabolisme en een sleutelcomponent is van een extra-hepatisch nutriënten-sensing orgaan communicatiemechanisme dat de systemische glucose homeostase controleert. Inzicht in de biologie van mTORC2 signalering in wit vet kan belangrijke aanwijzingen bevatten over hoe wit vetweefsel functioneert als een glucose sensing orgaan en mediator van systemische metabole fitness.
Witte adipocyten hebben mTORC2 nodig voor een normaal koolhydraat- en lipidenmetabolisme. We hebben ontdekt dat genetisch verlies van Rictor (mTORC2) specifiek in witte adipocyten de glucose-opname vermindert en de expressie van de ChREBP-beta transcriptiefactor en zijn downstream targets – waaronder de enzymen die functioneren in de de novo lipogenese pathway – vermindert. Bovendien leidt een mTORC2-deficiëntie in witte vetcellen tot ernstige leverinsulineresistentie. Deze gegevens wijzen erop dat mTORC2 in witte vetcellen een essentiële regulator is van het koolhydraat- en lipidenmetabolisme en een sleutelcomponent is van een extra-hepatisch nutriënten-sensing orgaan communicatiemechanisme dat de systemische glucose homeostase controleert. Inzicht in de biologie van mTORC2 signalering in wit vet kan belangrijke aanwijzingen bevatten over hoe wit vetweefsel functioneert als een glucose sensing orgaan en mediator van systemische metabole fitness.