Beginselen van de biologie
Nadat we hebben geleerd dat bij chemische reacties energie vrijkomt wanneer energie-opslagbindingen worden verbroken, is een belangrijke volgende vraag de volgende: Hoe wordt de energie die bij deze chemische reacties vrijkomt gekwantificeerd en uitgedrukt? Hoe kan de energie die vrijkomt bij de ene reactie worden vergeleken met die van een andere reactie? Een meting van de vrije energie wordt gebruikt om deze energieoverdrachten te kwantificeren. Bedenk dat volgens de tweede wet van de thermodynamica alle energie-overdrachten gepaard gaan met het verlies van een hoeveelheid energie in een onbruikbare vorm, zoals warmte. De vrije energie is de energie die beschikbaar is bij een chemische reactie, nadat rekening is gehouden met de verliezen. Met andere woorden, vrije energie is bruikbare energie, of energie die beschikbaar is om arbeid te verrichten. Als we dit concept in biologische zin bekijken, is vrije energie de energie in een molecuul die kan worden gebruikt om arbeid te verrichten. Glucose heeft veel vrije energie omdat er veel energie is opgeslagen in de bindingen van het glucosemolecuul. Kooldioxide heeft een veel lagere vrije energie omdat er veel minder energie is opgeslagen in de bindingen.
Als er energie vrijkomt bij een chemische reactie, dan zal de verandering in vrije energie bij de omzetting van de reactanten in de producten, aangeduid als ΔG (delta G) een negatief getal zijn. Een negatieve verandering in vrije energie betekent ook dat de producten van de reactie minder vrije energie hebben dan de reactanten, omdat ze bij de reactie wat vrije energie vrijmaken. Reacties die een negatieve verandering in vrije energie hebben en dus vrije energie vrijmaken heten exergonische reacties. Denk: exergetisch betekent dat er energie uit het systeem gaat. Deze reacties worden ook wel spontane reacties genoemd, en hun producten hebben minder opgeslagen energie dan de reactanten. Een belangrijk onderscheid moet worden gemaakt tussen de term spontaan en het idee dat een chemische reactie onmiddellijk optreedt. In tegenstelling tot het alledaagse gebruik van de term, is een spontane reactie niet een reactie die plotseling of snel optreedt. Het roesten van ijzer is een voorbeeld van een spontane reactie die langzaam, beetje bij beetje, in de loop van de tijd optreedt.
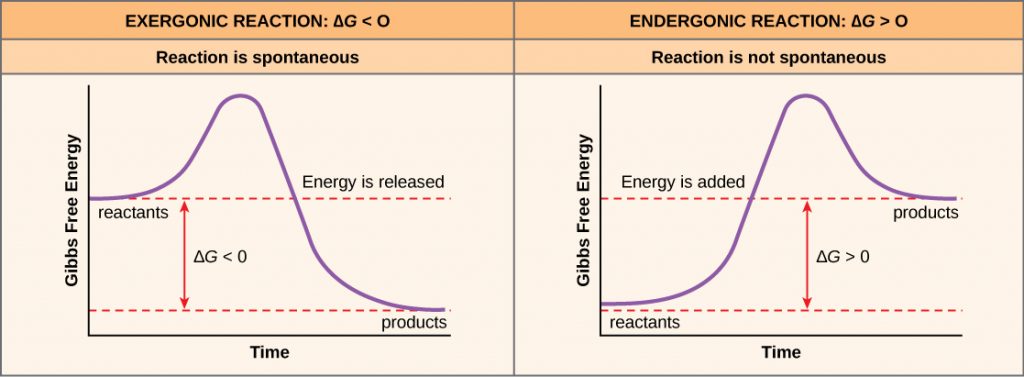
Als een chemische reactie per saldo eerder energie absorbeert dan energie vrijgeeft, dan zal de ΔG voor die reactie een positieve waarde hebben. In dat geval hebben de producten meer vrije energie dan de reactanten. De producten van deze reacties kunnen dus worden beschouwd als energie-opslagmoleculen. Deze chemische reacties worden endergonische reacties genoemd en ze zijn niet spontaan.
Een endergonische reactie vindt niet vanzelf plaats zonder toevoeging van vrije energie.

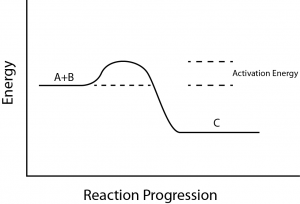
Er is nog een belangrijk concept dat in aanmerking moet worden genomen bij endergonische en exergonische reacties. Exergonische reacties hebben een kleine hoeveelheid energie nodig om op gang te komen, voordat ze verder kunnen gaan met hun energie-afleverende stappen.
Bij deze reacties komt netto energie vrij, maar is in het begin nog wel enige energie-input nodig. Deze kleine hoeveelheid energie die nodig is om alle chemische reacties te laten verlopen, wordt de activeringsenergie genoemd (figuur 3).
Tenzij anders vermeld, zijn de afbeeldingen op deze pagina gelicenseerd onder CC-BY 4.0 door OpenStax.
Tekst aangepast van: OpenStax, Concepten van Biologie. OpenStax CNX. 18 mei 2016 http://cnx.org/contents/[email protected]