Chemistry for Non-Majors
Learning Objectives
- Define atomic radius.
- Describe how the atomic changes within a period.
- Describe how the atomic radius changes within a period.
- Beschrijf hoe de atoomstraal verandert binnen een groep.
Hoe passen al die mensen in zo’n kleine ruimte?
 Evenementen trekken grote aantallen mensen naar zich toe. Zelfs een openluchtevenement kan zo vollopen dat er geen plaats meer is voor meer mensen. De capaciteit van de menigte hangt af van de hoeveelheid ruimte in de zaal, en de hoeveelheid ruimte hangt af van de grootte van de voorwerpen die de zaal vullen. We kunnen meer mensen in een bepaalde ruimte krijgen dan olifanten, omdat olifanten groter zijn dan mensen. Om dezelfde reden kunnen we meer eekhoorns in diezelfde ruimte krijgen dan mensen. Weten hoe groot de voorwerpen zijn waarmee we te maken hebben, kan van belang zijn om te bepalen hoeveel ruimte er nodig is.
Evenementen trekken grote aantallen mensen naar zich toe. Zelfs een openluchtevenement kan zo vollopen dat er geen plaats meer is voor meer mensen. De capaciteit van de menigte hangt af van de hoeveelheid ruimte in de zaal, en de hoeveelheid ruimte hangt af van de grootte van de voorwerpen die de zaal vullen. We kunnen meer mensen in een bepaalde ruimte krijgen dan olifanten, omdat olifanten groter zijn dan mensen. Om dezelfde reden kunnen we meer eekhoorns in diezelfde ruimte krijgen dan mensen. Weten hoe groot de voorwerpen zijn waarmee we te maken hebben, kan van belang zijn om te bepalen hoeveel ruimte er nodig is.
De grootte van atomen is van belang wanneer we het gedrag van atomen of verbindingen proberen te verklaren. Een van de manieren waarop we de grootte van atomen kunnen uitdrukken is met de atomaire straal . Deze gegevens helpen ons te begrijpen waarom sommige moleculen in elkaar passen en waarom andere moleculen delen hebben die onder bepaalde omstandigheden te vol worden.
De grootte van een atoom wordt bepaald door de rand van zijn baan. De grenzen van de orbitalen zijn echter vaag en variëren in feite onder verschillende omstandigheden. Om de meting van atomaire stralen te standaardiseren, wordt de afstand gemeten tussen de kernen van twee identieke atomen die aan elkaar gebonden zijn. De atomaire straal wordt gedefinieerd als de helft van de afstand tussen de kernen van identieke atomen die aan elkaar gebonden zijn.

Figuur 1. De atoomstraal (r) van een atoom kan worden gedefinieerd als de helft van de afstand (d) tussen twee kernen in een diatomisch molecuul.
Atomaire stralen zijn gemeten voor elementen. De eenheden voor atomaire stralen zijn picometers, gelijk aan 10-12 meter. Bij wijze van voorbeeld: de interne-ucleaire afstand tussen de twee waterstofatomen in een H2-molecuul is gemeten op 74 pm. De atoomstraal van een waterstofatoom is dus \frac{74}{2}=37{ pm}.
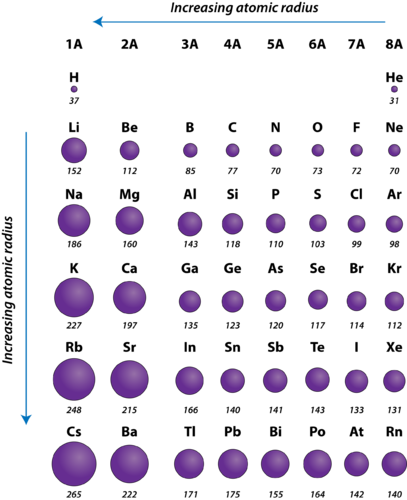
Figuur 2. Atoomstraal van de representatieve elementen gemeten in picometers.
Periodieke trend
De atoomstraal van atomen neemt over het algemeen van links naar rechts in een periode af. Er zijn enkele kleine uitzonderingen, zoals de zuurstofradius die iets groter is dan de stikstofradius. Binnen een periode worden protonen aan de kern toegevoegd terwijl elektronen worden toegevoegd aan hetzelfde voornaamste energieniveau. Deze elektronen worden geleidelijk dichter naar de kern getrokken vanwege zijn toegenomen positieve lading. Aangezien de aantrekkingskracht tussen kernen en elektronen toeneemt, neemt de omvang van de atomen af. Dit effect wordt minder naarmate men verder naar rechts in een periode gaat, vanwege de elektron-elektron afstoting die anders de atomen groter zou maken.
Groepstrend
De atoomstraal van atomen neemt in het algemeen toe van boven naar beneden binnen een groep. Naarmate het atoomnummer lager in een groep toeneemt, neemt ook de positieve kernlading toe. Er is echter ook een toename van het aantal bezette hoofdenergieniveaus. Hogere hoofdenergieniveaus bestaan uit orbitalen die groter in omvang zijn dan de orbitalen van lagere energieniveaus. Het effect van het grotere aantal hoofdenergieniveaus weegt op tegen de toename van de kernlading en dus neemt de atoomstraal naar beneden toe.

Figuur 3. A graph of atomic radius plotted versus atomic number. Each successive period is shown in a different color. As the atomic number increases within a period, the atomic radius decreases.
Summary
- Atomic radius is determined as the distance between the nuclei of two identical atoms bonded together.
- The atomic radius of atoms generally decreases from left to right across a period.
- The atomic radius of atoms generally increases from top to bottom within a group.
Practice
Use the link below to answer the following questions:
http://chemwiki.ucdavis.edu/Inorganic_Chemistry/Descriptive_Chemistry/Periodic_Table_of_the_Elements/Atomic_Radi
- What influences the atomic size of an atom?
- What is a covalent radius?
- What is an ionic radius?
Review
- Define “atomic radius.”
- What are the units for measurement of atomic radius?
- How does the atomic radius change across a period?
- How does atomic radius change from top to bottom within a group?
- Explain why the atomic radius of hydrogen is so much smaller that the atomic radius for potassium.