De toekomst van insuline: 6 alternatieven voor insuline-injecties
Waarom spuiten we eigenlijk insuline in?
Er zijn – misschien binnenkort wel – verschillende redenen. Ten eerste wordt insuline tijdens de spijsvertering afgebroken. Insuline is een poly-peptide eiwit, maar tegen de tijd dat het de handschoen van verschillende enzymen en sappen heeft afgelegd, is het uiteindelijk nog maar een enkele peptide, die een beetje nutteloos is.
Zelfs als het zou werken, zou het niet goed genoeg werken. Insuline moet specifiek worden gemeten om de specifieke kenmerken van je bloedglucose aan te pakken. Voeding, lichaamsbeweging, stress – er is een veelheid aan omstandigheden die je suikerspiegel kunnen beïnvloeden.
Injecties met insuline komen direct in het bloed terecht met een minimum aan gedoe. Het wordt niet afgebroken of verandert niet veel, omdat het rechtstreeks in het onderhuidse vet terechtkomt. Insuline is zorgvuldig ontworpen om binnen een bepaalde tijd te werken; daarom hebben we langwerkende, snelwerkende, en vele andere soorten insuline. Als insuline rechtstreeks in de bloedbaan terecht zou komen, zou het te snel worden opgenomen.
Insulinebehandeling is een zorgvuldig gechoreografeerd proces. Alleen door injectie werkt het precies zoals het moet werken.
Degenen onder u die op de hoogte zijn van het laatste diabetesnieuws, zullen geeuwen en met de ogen rollen over mijn ouderwetse toewijding aan geïnjecteerde insuline. U kent uw Afrezza van uw Exubera, en u weet dat effectieve alternatieve insulinebehandelingen wel eens om de hoek zouden kunnen liggen.
Maar dergelijke ontwikkelingen zijn er nog niet, en de paragrafen hierboven leggen uit waarom. Dit zijn de uitdagingen waar fabrikanten voor staan: we willen een handigere vorm van insulinebehandeling ontwikkelen, maar hoe zorgen we ervoor dat die nauwgezet functioneert?
Om te beginnen heeft geïnjecteerde insuline zo zijn problemen: het is ongemakkelijk – niemand houdt ervan zichzelf met naalden te prikken, zelfs niet als dat van levensbelang is; voor sommige mensen met type 1-diabetes is het een schrijnend proces om de naaldfobie te overwinnen; en insuline-injecties kunnen je huid bobbelig en gekneusd maken.
Een ding is zeker beter dan vroeger – kort na de uitvinding van insuline-injecties was het alsof je jezelf met een breinaald prikte – maar een minder onaangenaam alternatief zou welkom zijn.
Er is een rijke geschiedenis van alternatieve vormen van insulinebehandeling.

Wie weet wat voor insuline-technologie we in de toekomst zullen zien? Bron: wallstreetotc.com
6. Nasale insuline
Insuline in de neus is ook niet ideaal. Maar het is wel geprobeerd. Het doel was om insuline direct aan de hersenen te leveren. Het werd nooit echt gebruikt als een behandeling voor type 1 diabetes. Onderzoekers waren er eerder in geïnteresseerd als behandeling voor cognitieve aandoeningen zoals Alzheimer, dat sterk samenhangt met hersenschade veroorzaakt door hoge bloedglucosespiegels.

Verrassend genoeg waren de mensen niet gecharmeerd van Exubera. Afbeelding bron: images.dailytech.com
5. Exubera
Ingevoerd in 2006, teruggetrokken in 2007 – Exubera was een leuk idee. Helaas was hij enorm, wat om twee redenen problematisch was: hij was moeilijk mee te nemen, en hij zag er eigenlijk een beetje vreemd uit.
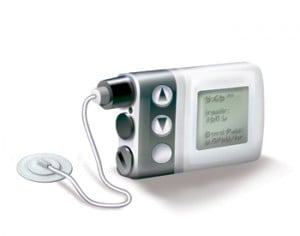
Image source: uofmchildrenshospital.org
4. Insulinepompen
Insulinepompen zijn nog steeds een beetje invasief, maar ze maken al het zelf prikken overbodig. In plaats daarvan worden ze bevestigd met behulp van een katheter die onder de huid wordt geplaatst. De bolusinsuline wordt automatisch toegediend, waarbij de gebruiker zelf kan bepalen wanneer en hoeveel.

Bron: in-pharmatechnologist.com
3. Afrezza
Afrezza is een snelwerkende, geïnhaleerde insuline. En, in tegenstelling tot de beruchte Exubera, is het echt heel klein, ongeveer zo groot als je duim. Het is slechts een maaltijd insuline, let wel; je hebt nog steeds je basale injecties nodig. Hoewel Afrezza is goedgekeurd door de Amerikaanse Food and Drug Administration, is er nog geen goed nieuws voor de Britse markt.

De jonge Xavier Hames, de eerste ontvanger van iets wat lijkt op een kunstmatige alvleesklier. Bron: Guardian.co.uk
2. Kunstmatige alvleesklier
De kunstmatige alvleesklier is er nog niet helemaal, maar het is wel een behoorlijk inspirerend idee. In theorie detecteert de kunstmatige alvleesklier lage bloedglucosespiegels en stopt in reactie daarop met het toedienen van insuline. Lange tijd hebben we geen gecombineerde insulinepomp en bloedglucosemeter gehad, maar een apart apparaat dat beide technologieën combineert.
In januari zagen we een doorbraak, toen de vierjarige Xavier Hames werd uitgerust met de allereerste kunstmatige pancreas. Het is een pomp die weet wanneer zijn bloedglucosespiegel laag is en dan stopt met het toedienen van insuline, zonder dat hij de pomp handmatig hoeft bij te stellen. Het probleem is dat het apparaat meer dan £5.000 kost.
Sindsdien beviel een dame uit Norfolk met behulp van de kunstmatige alvleesklier van een gezonde baby.

De bionische alvleesklier. Bron: nbcnews.com
1. Bionische alvleesklier
De bionische alvleesklier is nog beter. Net als de kunstmatige alvleesklier kan de bionische alvleesklier lage bloedglucosespiegels detecteren en op dat moment de toediening van insuline stopzetten. In tegenstelling tot de kunstmatige pancreas kan de bionische pancreas ook glucagon toedienen, waardoor hij in staat is hypoglykemie te behandelen.
Je hebt twee pompen – een voor insuline, en een voor glucagon – en een iPhone. Door het gebruik van Bluetooth-technologie kunnen de twee pompen via de iPhone communiceren en op basis van continue glucosemonitoring bepalen hoeveel van elk nodig is. Voor mij klinkt het alsof het gebruikt zou kunnen worden door de Terminator, maar ik ben snel verbijsterd door technologie.
De bionische alvleesklier wordt ontwikkeld door onderzoekers van de Boston University. Het team hoopt later dit jaar de laatste klinische proef uit te voeren, en het eind 2017 op de markt te hebben.