19.1: Polypeptides and Proteins
Learning Objectives
- Define or describe the following:
- amino acid
- „R“ group
- peptide bond
- peptide
- polypeptide
- primary protein structure
- secondary protein structure
- tertiary protein structure
- quaternary protein structure
- gene
- Describe how the primary structure of a protein or polypeptide ultimately detemines its final three-dimensional shape.
- Describe how the order of nucleotide bases in DNA ultimately determines the final three-dimensional shape of a protein or polypeptide.
Amino acids are the building blocks for proteins. All amino acids contain an amino or NH2 group and a carboxyl (acid) or COOH group. There are 20 different amino acids commonly found in proteins and often 300 or more amino acids per protein molecule. Jede Aminosäure unterscheidet sich durch ihre „R“-Gruppe. Die „R“-Gruppe einer Aminosäure ist der Rest des Moleküls, d. h. der Teil außer der Aminogruppe, der Säuregruppe und dem zentralen Kohlenstoff. Jede unterschiedliche Aminosäure hat eine einzigartige „R“-Gruppe, und die einzigartigen chemischen Eigenschaften einer Aminosäure hängen von ihrer „R“-Gruppe ab (Abbildung \(\PageIndex{1}\)).
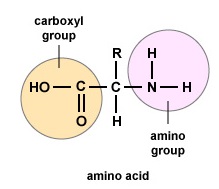
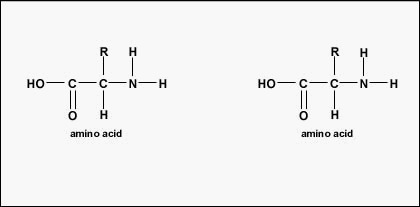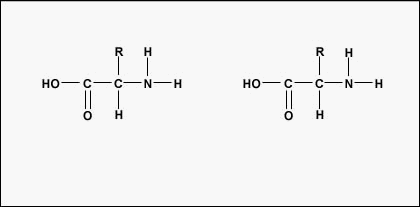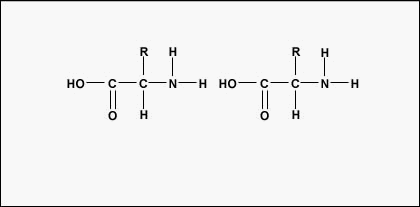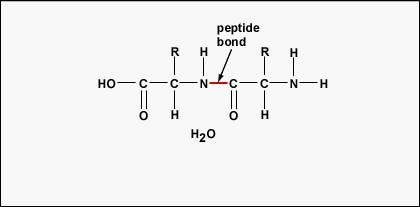
Um Polypeptide und Proteine zu bilden, werden Aminosäuren durch Peptidbindungen miteinander verbunden, bei denen sich die Amino- oder NH2-Gruppe einer Aminosäure an die Carboxyl- (Säure) oder COOH-Gruppe einer anderen Aminosäure bindet, wie in (Abbildung \(\PageIndex{2}\) und Abbildung \(\PageIndex{3}\)) dargestellt.
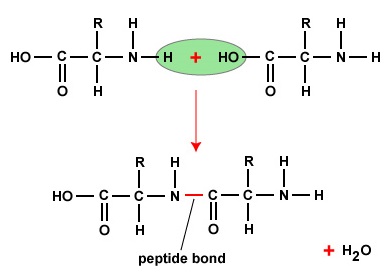
Ein Peptid sind zwei oder mehr Aminosäuren, die durch Peptidbindungen miteinander verbunden sind, und ein Polypeptid ist eine Kette aus vielen Aminosäuren. Ein Protein enthält ein oder mehrere Polypeptide. Proteine sind also lange Ketten von Aminosäuren, die durch Peptidbindungen zusammengehalten werden.
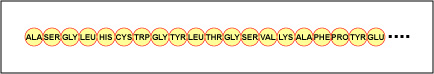
Die tatsächliche Anordnung der Aminosäuren im Protein wird als Primärstruktur bezeichnet (Abbildung \(\PageIndex{4}\)) und wird durch die DNA bestimmt. Wie wir später in dieser Einheit sehen werden, ist die DNA in funktionelle Einheiten, die Gene, unterteilt. Ein Gen ist eine Sequenz von Desoxyribonukleotidbasen entlang eines DNA-Strangs, die für ein funktionelles Produkt kodiert – ein bestimmtes Molekül von Boten-RNA, Transfer-RNA oder ribosomaler RNA. Bei dem Produkt handelt es sich in der Regel um Boten-RNA (mRNA), und mRNA führt letztendlich zur Synthese eines Polypeptids oder eines Proteins. Daher sagt man gemeinhin, dass die Reihenfolge der Desoxyribonukleotidbasen in einem Gen die Aminosäuresequenz eines bestimmten Proteins bestimmt. Da bestimmte Aminosäuren mit anderen Aminosäuren im selben Protein interagieren können, bestimmt diese Primärstruktur letztlich die endgültige Form und damit die chemischen und physikalischen Eigenschaften des Proteins.
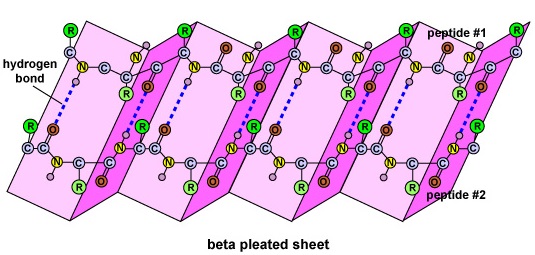
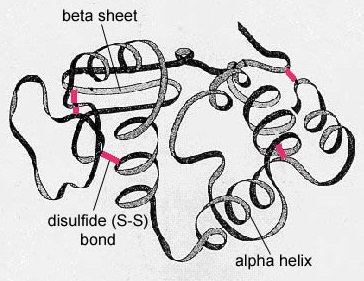
Die Sekundärstruktur des Proteins entsteht durch Wasserstoffbrücken, die sich zwischen dem Sauerstoffatom einer Aminosäure und dem Stickstoffatom einer anderen bilden. Dadurch erhält das Protein oder Polypeptid die zweidimensionale Form einer Alpha-Helix oder eines Beta-Faltblattes (Abbildung \(\PageIndex{5}\)).
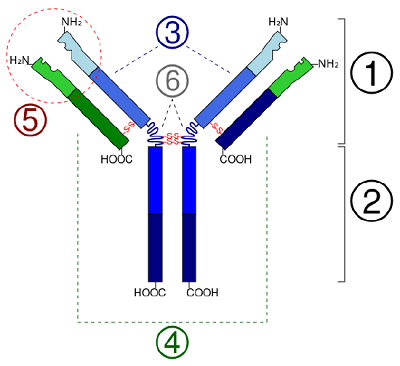
In globulären Proteinen, wie z. B. Enzymen, wird die lange Kette von Aminosäuren zu einer dreidimensionalen funktionellen Form oder Tertiärstruktur gefaltet. Der Grund dafür ist, dass bestimmte Aminosäuren mit Sulfhydryl- oder SH-Gruppen Disulfidbindungen (S-S) mit anderen Aminosäuren in derselben Kette bilden. Andere Wechselwirkungen zwischen R-Gruppen von Aminosäuren wie Wasserstoffbrücken, Ionenbindungen, kovalente Bindungen und hydrophobe Wechselwirkungen tragen ebenfalls zur Tertiärstruktur bei (Abbildung \(\PageIndex{6}\)). Bei einigen Proteinen, wie z. B. Antikörpermolekülen und Hämoglobin, können mehrere Polypeptide miteinander verbunden sein, um eine quaternäre Struktur zu bilden (Abbildung \(\PageIndex{7}\)).
Wie später in dieser Einheit zu sehen sein wird, wird bei der Proteinsynthese die Reihenfolge der Nukleotidbasen entlang eines Gens in einen komplementären mRNA-Strang transkribiert, der dann von der tRNA in die richtige Reihenfolge der Aminosäuren für dieses Polypeptid oder Protein übersetzt wird. Daher bestimmt die Reihenfolge der Desoxyribonukleotidbasen entlang der DNA die Reihenfolge der Aminosäuren in den Proteinen. Da bestimmte Aminosäuren mit anderen Aminosäuren interagieren können, bestimmt die Reihenfolge der Aminosäuren für jedes Protein seine endgültige dreidimensionale Form, die wiederum die Funktion des Proteins bestimmt (z. B, mit welchem Substrat ein Enzym reagiert, mit welchen Epitopen sich die Fab eines Antikörpers verbindet, an welche Rezeptoren ein Zytokin bindet).
Zusammenfassung
- Aminosäuren sind die Bausteine für Proteine. Es gibt 20 verschiedene Aminosäuren, die in Proteinen vorkommen, und oft 300 oder mehr Aminosäuren pro Proteinmolekül.
- Alle Aminosäuren enthalten eine Amino- oder NH2-Gruppe und eine Carboxyl- (Säure-) oder COOH-Gruppe.
- Um Polypeptide und Proteine zu bilden, werden Aminosäuren durch Peptidbindungen miteinander verbunden, wobei die Amino- oder NH2-Gruppe einer Aminosäure an die Carboxyl- (Säure) oder COOH-Gruppe einer anderen Aminosäure gebunden wird.
- Ein Peptid sind zwei oder mehr Aminosäuren, die durch Peptidbindungen miteinander verbunden sind; ein Polypeptid ist eine Kette aus vielen Aminosäuren; und ein Protein enthält ein oder mehrere Polypeptide. Proteine sind also lange Ketten von Aminosäuren, die durch Peptidbindungen zusammengehalten werden.
- Die tatsächliche Anordnung der Aminosäuren im Protein wird als seine Primärstruktur bezeichnet und durch die DNA bestimmt.
- Die Reihenfolge der Desoxyribonukleotidbasen in einem Gen bestimmt die Aminosäuresequenz eines bestimmten Proteins. Da bestimmte Aminosäuren mit anderen Aminosäuren desselben Proteins interagieren können, bestimmt diese Primärstruktur letztlich die endgültige Form und damit die chemischen und physikalischen Eigenschaften des Proteins.
- Die Sekundärstruktur des Proteins ist auf Wasserstoffbrückenbindungen zurückzuführen, die sich zwischen dem Sauerstoffatom einer Aminosäure und dem Stickstoffatom einer anderen bilden und dem Protein oder Polypeptid die zweidimensionale Form einer Alpha-Helix oder eines Beta-Faltblattes verleihen.
- In globulären Proteinen wie Enzymen wird die lange Kette von Aminosäuren zu einer dreidimensionalen funktionellen Form oder Tertiärstruktur gefaltet. Das liegt daran, dass bestimmte Aminosäuren mit Sulfhydryl- oder SH-Gruppen Disulfidbindungen (S-S) mit anderen Aminosäuren in derselben Kette bilden. Andere Wechselwirkungen zwischen R-Gruppen von Aminosäuren wie Wasserstoffbrücken, Ionenbindungen, kovalente Bindungen und hydrophobe Wechselwirkungen tragen ebenfalls zur Tertiärstruktur bei.
- In some proteins, such as antibody molecules, several polypeptides may bond together to form a quaternary structure.
Contributors and Attributions
-
Dr. Gary Kaiser (COMMUNITY COLLEGE OF BALTIMORE COUNTY, CATONSVILLE CAMPUS)