4. Starke und schwache Basen
Schwache Basen
Ammoniak ist eine typische schwache Base. Ammoniak selbst enthält natürlich keine Hydroxidionen, aber es reagiert mit Wasser unter Bildung von Ammonium- und Hydroxidionen.
Die Reaktion ist jedoch umkehrbar, und zu jedem Zeitpunkt sind etwa 99 % des Ammoniaks noch als Ammoniakmoleküle vorhanden. Nur etwa 1 % hat tatsächlich Hydroxid-Ionen gebildet. Eine schwache Base ist eine Base, die sich in Lösung nicht vollständig in Hydroxidionen umwandelt. Wenn eine schwache Base mit Wasser reagiert, variiert die Position des Gleichgewichts von Base zu Base. Je weiter links sie liegt, desto schwächer ist die Base.
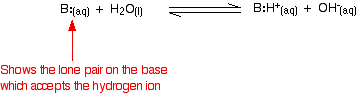
Ein Maß für die Gleichgewichtslage einer Reaktion erhält man, indem man eine Gleichgewichtskonstante für die Reaktion schreibt. Je niedriger der Wert für die Konstante ist, desto weiter links liegt das Gleichgewicht. In diesem Fall wird die Gleichgewichtskonstante Kb genannt. Diese ist definiert als:
\}{}\]
The relationship between Kb and pKb is exactly the same as all the other „p“ terms in this topic:
\
The table shows some values for \(K_b\) and \(pK_b\) for some weak bases.
| base | Kb (mol dm-3) | pKb |
|---|---|---|
| C6H5NH2 | 4.17 x 10-10 | 9.38 |
| NH3 | 1.78 x 10-5 | 4.75 |
| CH3NH2 | 4.37 x 10-4 | 3.36 |
| CH3CH2NH2 | 5.37 x 10-4 | 3.27 |