Adipozyten
Adipozyten sind die wichtigsten Energiespeicher im Körper und haben auch wichtige endokrine Funktionen. Daher ist das Verständnis der Entwicklung und Funktion von Adipozyten – insbesondere im Hinblick auf die Adipositas-Pandemie – für das Verständnis der metabolischen Homöostase von wesentlicher Bedeutung. Es gibt zwei allgemeine Klassen von Adipozyten: weiße Adipozyten, die Energie in einem einzigen großen Lipidtröpfchen speichern und wichtige endokrine Funktionen haben, und braune Adipozyten, die Energie in mehreren kleinen Lipidtröpfchen speichern, aber speziell für die Verwendung als Brennstoff zur Erzeugung von Körperwärme (d. h. Thermogenese). Die Wärmeerzeugung durch braune Adipozyten wird durch ihre einzigartige Expression von mitochondrial lokalisiertem uncoupling protein 1 (Ucp1) ermöglicht. Diese Klassifizierungen sind jedoch stark vereinfacht, da einige weiße Adipozyten je nach Temperatur und Ernährung braune Adipozyteneigenschaften annehmen können (so genannte brite oder beige Adipozyten) und umgekehrt. Wir sind daran interessiert, die Ursprünge der verschiedenen Adipozyten zu verstehen und die Signal- und Stoffwechselwege zu definieren, die ihre Entwicklung, Verteilung und Funktion steuern.
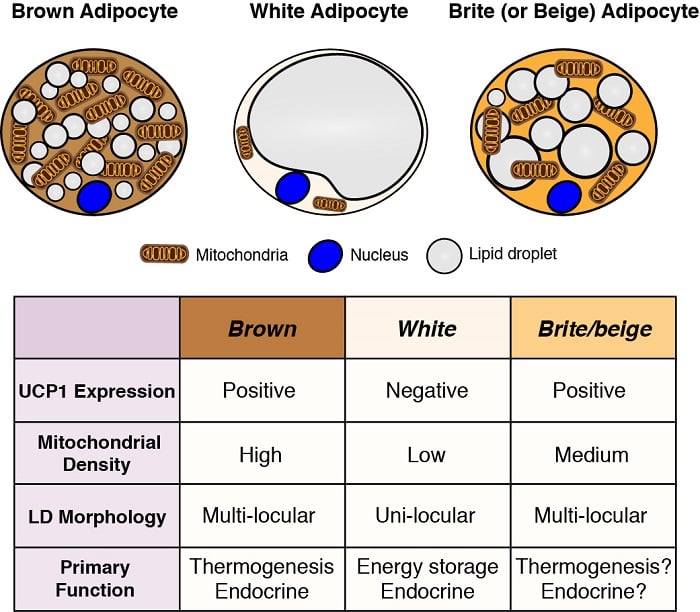
Ursprünge von Adipozyten
Um die Rolle des Fettgewebes bei Gesundheit und Krankheit zu verstehen, muss man wissen, wie es wächst, und in dieser Hinsicht ist einer der am wenigsten verstandenen Bereiche der Biologie des Fettgewebes der Entwicklungsursprung der verschiedenen Arten von Adipozyten. Die Bestimmung des Ursprungs der Adipozyten könnte dazu beitragen, die Verteilung des menschlichen Körperfetts zu erklären, insbesondere bei fettleibigen oder lipodystrophischen Personen, und sie könnte Hinweise auf metabolische Unterschiede liefern, die zwischen einigen Fettdepots beobachtet werden. Die Identifizierung von Adipozyten-Vorläuferzellen und der Mechanismen, die ihre Ausbreitung regulieren, ist ebenfalls entscheidend für das Verständnis und die Steuerung der Funktion eines gesunden Fettgewebes. Es könnte auch möglich sein, die Entwicklung „gesunder“ Adipozyten (wie braune oder brite/beige Adipozyten) aus Vorläuferzellen für zellbasierte Therapien zu entwickeln, die im Wesentlichen darauf abzielen, Fett mit Fett zu bekämpfen. Mithilfe einer Kombination aus Genetik und Strategien zur Nachverfolgung der Abstammung haben wir zuvor die Herkunft von Adipozyten in den verschiedenen Depots kartiert. Unsere Ergebnisse zeigen ein unerwartetes Ausmaß an Heterogenität, das darauf hindeutet, dass Adipozyten mehrere Entwicklungsursprünge haben und ein Modell unterstützen, bei dem das Schicksal der Adipozyten wahrscheinlich sowohl von extrinsischen als auch intrinsischen Faktoren abhängt.
Adipozyten haben mehrere Entwicklungsursprünge
(unten links) Anatomische Verteilung der Fettgewebedepots in einer Maus. Abgebildet sind die Depots des braunen Fettgewebes (BAT) und des weißen Fettgewebes (WAT). (unten rechts) Beispiel eines Experiments zur Rückverfolgung der Abstammung, bei dem Vorläuferzellen und alle ihre Nachkommen unauslöschlich mit einer Fluoreszenzmarkierung versehen wurden, die mit der Expression von Myf5 (Tafel a) oder Pax3 (Tafel b) verbunden ist. Die grün markierten Adipozyten (mGFP) stammen von einer anderen Vorläuferzelle ab als die rot markierten Adipozyten (mTFP).
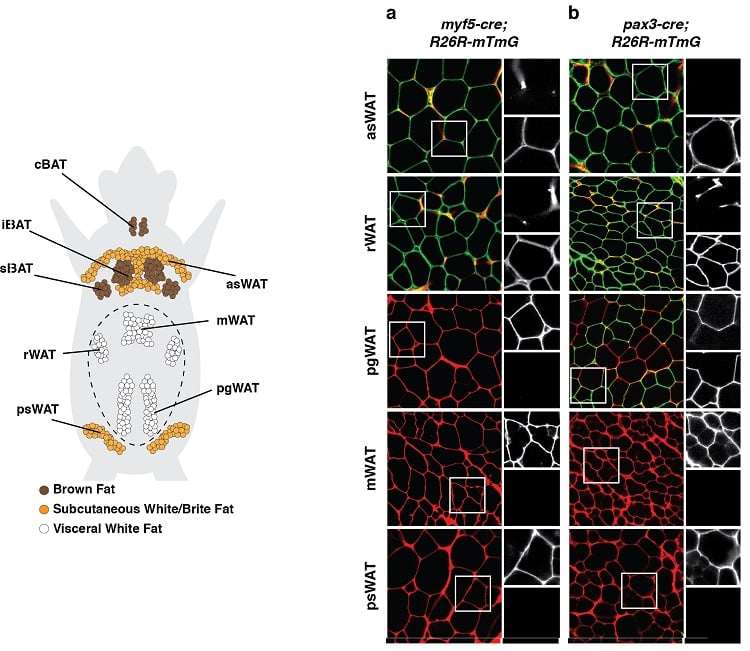
Ergebnisse wie diese legen nahe, dass Adipozyten mehrere Entwicklungsursprünge haben.
(angepasst aus Sanchez-Gurmaches & Guertin, Nature Communications 2014; Sanchez-Gurmaches et al., Trends in Cell Biology 2016)
Braune Adipozyten
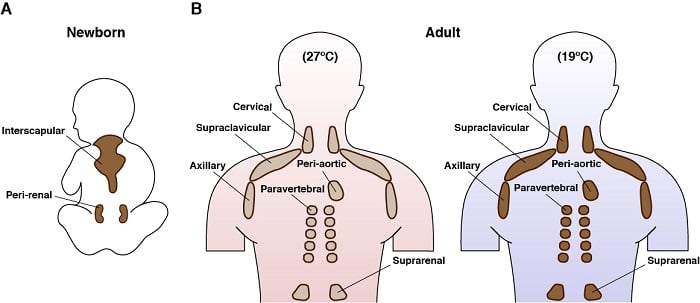
Braune Adipozyten sind faszinierende Zellen. Sie kommen nur bei Säugetieren vor und ihre Hauptfunktion ist die Erzeugung körpereigener Wärme in einem Prozess, der Thermogenese genannt wird. Dies wird durch ihre einzigartige Expression eines mitochondrialen Membranproteins, des so genannten Entkopplungsproteins 1 (UCP1), ermöglicht. Die energieverbrauchenden Eigenschaften des braunen Fettes und die jüngste Erkenntnis, dass auch erwachsene Menschen braunes Fett haben, haben sie zu einem Ziel für Therapien gemacht, die auf die Bekämpfung von Überernährung abzielen. Aktive braune Fettzellen haben auch eines der faszinierendsten Stoffwechselprogramme: Sie nehmen große Mengen verschiedener Nährstoffe gleichzeitig auf (z. B. Glukose, Lipide, Aminosäuren) und können gleichzeitig einen anabolen und katabolen Stoffwechsel betreiben. So haben wir und andere bereits gezeigt, dass kältestimulierte BAT ein genetisches Programm hochregulieren, das neben der Fettsäureoxidation auch die De-novo-Lipidsynthese fördert. Wir würden gerne mehr über diesen bemerkenswerten und paradoxen Stoffwechsel erfahren.
Erfahren Sie mehr über die Entwicklung und den Stoffwechsel des braunen Fettgewebes
Anatomische Lage des braunen Fettgewebes beim Menschen
Wir verwenden auch genetische Modelle, um zu untersuchen, wie Signalwege den BAT-Stoffwechsel steuern. Zum Beispiel haben wir bei Mäusen Rictor – das für eine einzigartige und wesentliche Komponente von mTORC2 kodiert – nur im braunen Fettgewebe genetisch entfernt. Erfahren Sie mehr über mTORC2. Bemerkenswerterweise sind diese Mäuse vor einer fettreichen Diät geschützt. Genauer gesagt: Mäuse, denen BAT Rictor fehlte, akkumulierten keine übermäßigen Lipide in der Leber oder im viszeralen Fettgewebe, wenn sie eine fettreiche Diät zu sich nahmen. Dies ist ein interessantes Ergebnis, da eine übermäßige Fettspeicherung in diesen Bereichen gefährlich ungesund ist. Mit einer Kombination aus Genetik, Genomik, Metabolomik und Biochemie versuchen wir zu verstehen, warum diese Mäuse vor einer fettreichen Ernährung geschützt sind.
Weiße Fettzellen
Weiße Fettzellen sind die am häufigsten vorkommenden Fettzellen des Menschen. Weiße Fettgewebedepots haben auch eine bemerkenswerte Fähigkeit, sich auszudehnen und Energie zu speichern, und sie senden Signale an das Gehirn und andere Gewebe, die das Ernährungsverhalten und die metabolische Homöostase stark beeinflussen. Obwohl die weißen Fettzellen speziell dafür ausgelegt sind, überschüssige Nährstoffe sicher zu speichern, gibt es einen Kipppunkt (z. B. bei Fettleibigkeit), an dem ihre nützlichen Funktionen versagen, was das Auftreten von Stoffwechselkrankheiten und Typ-2-Diabetes stark fördert. Wodurch wird der Kipppunkt definiert? Wie senden die weißen Fettzellen Signale an andere Gewebe? Wie heterogen sind die Depots des weißen Fettgewebes? Warum ist ein Übermaß an viszeralem Fett für die Gesundheit schädlicher als ein Übermaß an subkutanem Fett? Dies sind alles offene Fragen, die uns interessieren.
Wir untersuchen auch die mTOR-Signalübertragung in weißen Fettzellen. mTOR ist ein wichtiges nachgeschaltetes Ziel der Insulinsignalübertragung, die das wichtigste Hormon ist, auf das Fettzellen reagieren. Mithilfe von genetischen Mausmodellen haben wir entweder mTORC1 oder mTORC2 in allen Fettzellen selektiv gehemmt. Die Hemmung von mTORC1 im weißen Fettgewebe führt zu einem lipodystrophieähnlichen Syndrom, das mit Insulinresistenz und Fettlebererkrankungen einhergeht. Die Hemmung von mTORC2 im weißen Fettgewebe führt ebenfalls zu Insulinresistenz, jedoch unabhängig von Veränderungen der Fettgewebemasse. Im letztgenannten Modell scheint mTORC2 ein von den Adipozyten stammendes Signal zu regulieren, das mit der Leber kommuniziert, um die hepatische Glukoseproduktion zu steuern. Das Verständnis der mechanistischen Grundlage dieser Phänotypen wird wichtige Informationen darüber liefern, wie nährstoffempfindliche Signaltransduktionswege zur Pathogenese von Erkrankungen des Fettgewebes beitragen.
Modell der mTORC2-Signalübertragung in einem weißen Adipozyten
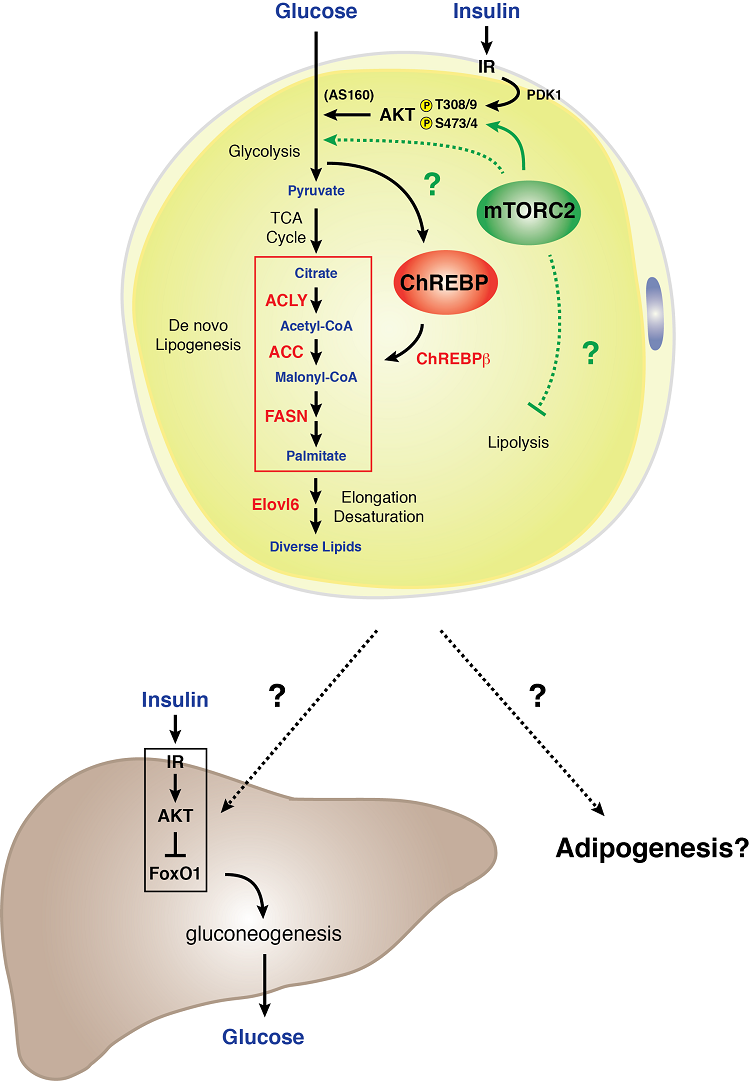 Weiße Adipozyten benötigen mTORC2 für einen normalen Kohlenhydrat- und Fettstoffwechsel. Wir fanden heraus, dass der genetische Verlust von Rictor (mTORC2) speziell in weißen Adipozyten die Glukoseaufnahme verringert und die Expression des Transkriptionsfaktors ChREBP-beta und seiner nachgeschalteten Ziele abschwächt, zu denen auch die Enzyme gehören, die im De-novo-Lipogenese-Stoffwechselweg funktionieren. Darüber hinaus führt ein mTORC2-Mangel in weißen Fettzellen zu einer schweren hepatischen Insulinresistenz. Diese Daten deuten darauf hin, dass mTORC2 in den weißen Fettzellen ein wesentlicher Regulator des Kohlenhydrat- und Fettstoffwechsels ist und eine Schlüsselkomponente eines Kommunikationsmechanismus zwischen den Organen außerhalb der Leber darstellt, der die systemische Glukosehomöostase steuert. Das Verständnis der Biologie der mTORC2-Signalübertragung im weißen Fettgewebe könnte wichtige Hinweise darauf liefern, wie das weiße Fettgewebe als Glukosesensororgan und Vermittler der systemischen metabolischen Fitness funktioniert.
Weiße Adipozyten benötigen mTORC2 für einen normalen Kohlenhydrat- und Fettstoffwechsel. Wir fanden heraus, dass der genetische Verlust von Rictor (mTORC2) speziell in weißen Adipozyten die Glukoseaufnahme verringert und die Expression des Transkriptionsfaktors ChREBP-beta und seiner nachgeschalteten Ziele abschwächt, zu denen auch die Enzyme gehören, die im De-novo-Lipogenese-Stoffwechselweg funktionieren. Darüber hinaus führt ein mTORC2-Mangel in weißen Fettzellen zu einer schweren hepatischen Insulinresistenz. Diese Daten deuten darauf hin, dass mTORC2 in den weißen Fettzellen ein wesentlicher Regulator des Kohlenhydrat- und Fettstoffwechsels ist und eine Schlüsselkomponente eines Kommunikationsmechanismus zwischen den Organen außerhalb der Leber darstellt, der die systemische Glukosehomöostase steuert. Das Verständnis der Biologie der mTORC2-Signalübertragung im weißen Fettgewebe könnte wichtige Hinweise darauf liefern, wie das weiße Fettgewebe als Glukosesensororgan und Vermittler der systemischen metabolischen Fitness funktioniert.