Chemie für Laien
Lernziele
- Bestimmen Sie den Atomradius.
- Beschreiben Sie, wie sich der Atomradius innerhalb einer Periode verändert.
- Beschreibe, wie sich der Atomradius innerhalb einer Gruppe verändert.
Wie können all diese Menschen auf so engem Raum Platz finden?
 Events ziehen eine große Anzahl von Menschen an. Selbst eine Veranstaltung im Freien kann sich so füllen, dass kein Platz mehr für weitere Personen ist. Die Zuschauerkapazität hängt von der Größe des Veranstaltungsortes ab, und die Größe des Raumes hängt von der Größe der Objekte ab, die ihn füllen. Wir können mehr Menschen in einen bestimmten Raum bringen als Elefanten, weil Elefanten größer sind als Menschen. Aus demselben Grund können wir auch mehr Eichhörnchen in denselben Raum bringen als Menschen. Die Kenntnis der Größe der Objekte, mit denen wir es zu tun haben, kann wichtig sein, um zu entscheiden, wie viel Platz benötigt wird.
Events ziehen eine große Anzahl von Menschen an. Selbst eine Veranstaltung im Freien kann sich so füllen, dass kein Platz mehr für weitere Personen ist. Die Zuschauerkapazität hängt von der Größe des Veranstaltungsortes ab, und die Größe des Raumes hängt von der Größe der Objekte ab, die ihn füllen. Wir können mehr Menschen in einen bestimmten Raum bringen als Elefanten, weil Elefanten größer sind als Menschen. Aus demselben Grund können wir auch mehr Eichhörnchen in denselben Raum bringen als Menschen. Die Kenntnis der Größe der Objekte, mit denen wir es zu tun haben, kann wichtig sein, um zu entscheiden, wie viel Platz benötigt wird.
Die Größe von Atomen ist wichtig, wenn man versucht, das Verhalten von Atomen oder Verbindungen zu erklären. Eine der Möglichkeiten, die Größe von Atomen auszudrücken, ist der Atomradius. Diese Daten helfen uns zu verstehen, warum manche Moleküle zusammenpassen und warum andere Moleküle Teile haben, die unter bestimmten Bedingungen zu eng werden.
Die Größe eines Atoms wird durch den Rand seines Orbitals definiert. Die Orbitalgrenzen sind jedoch unscharf und können unter verschiedenen Bedingungen variieren. Um die Messung von Atomradien zu standardisieren, wird der Abstand zwischen den Kernen zweier identischer Atome gemessen, die miteinander verbunden sind. Der Atomradius ist definiert als die Hälfte des Abstands zwischen den Kernen identischer Atome, die aneinander gebunden sind.

Abbildung 1. Der Atomradius (r) eines Atoms kann als die Hälfte des Abstands (d) zwischen zwei Kernen in einem zweiatomigen Molekül definiert werden.
Atomradien sind für Elemente gemessen worden. Die Einheiten für Atomradien sind Pikometer, was 10-12 Metern entspricht. Der Abstand zwischen den beiden Wasserstoffatomen in einem H2-Molekül wird beispielsweise mit 74 pm gemessen. Daher ist der Atomradius eines Wasserstoffatoms \frac{74}{2}=37\text{ pm}.
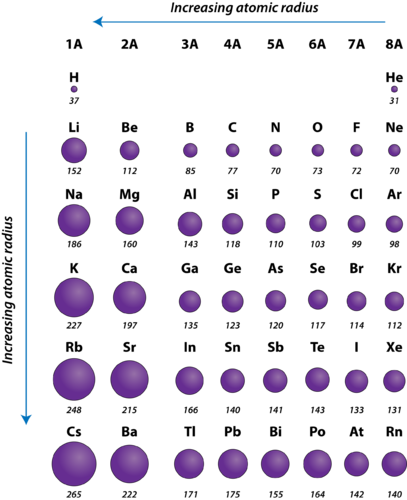
Abbildung 2. Atomradien der repräsentativen Elemente, gemessen in Pikometern.
Periodischer Trend
Der Atomradius von Atomen nimmt im Allgemeinen über eine Periode hinweg von links nach rechts ab. Es gibt einige kleine Ausnahmen, z. B. ist der Sauerstoffradius etwas größer als der Stickstoffradius. Innerhalb einer Periode werden dem Kern Protonen hinzugefügt, während Elektronen auf dem gleichen Hauptenergieniveau hinzugefügt werden. Diese Elektronen werden aufgrund der erhöhten positiven Ladung des Kerns allmählich näher an diesen herangezogen. Da die Anziehungskraft zwischen Kernen und Elektronen zunimmt, verringert sich die Größe der Atome. Der Effekt nimmt ab, je weiter man sich in einer Periode nach rechts bewegt, da die Abstoßung zwischen Elektronen und Kernen sonst zu einer Vergrößerung des Atoms führen würde.
Gruppentrend
Der Atomradius der Atome nimmt innerhalb einer Gruppe im Allgemeinen von oben nach unten zu. Mit zunehmender Ordnungszahl innerhalb einer Gruppe nimmt auch die positive Kernladung zu. Allerdings nimmt auch die Zahl der besetzten Hauptenergieniveaus zu. Höhere Hauptenergieniveaus bestehen aus Orbitalen, die größer sind als die Orbitale der niedrigeren Energieniveaus. Der Effekt der größeren Anzahl von Hauptenergieniveaus überwiegt die Zunahme der Kernladung, so dass der Atomradius in einer Gruppe nach unten zunimmt.

Abbildung 3. A graph of atomic radius plotted versus atomic number. Each successive period is shown in a different color. As the atomic number increases within a period, the atomic radius decreases.
Summary
- Atomic radius is determined as the distance between the nuclei of two identical atoms bonded together.
- The atomic radius of atoms generally decreases from left to right across a period.
- The atomic radius of atoms generally increases from top to bottom within a group.
Practice
Use the link below to answer the following questions:
http://chemwiki.ucdavis.edu/Inorganic_Chemistry/Descriptive_Chemistry/Periodic_Table_of_the_Elements/Atomic_Radi
- What influences the atomic size of an atom?
- What is a covalent radius?
- What is an ionic radius?
Review
- Define „atomic radius.“
- What are the units for measurement of atomic radius?
- How does the atomic radius change across a period?
- How does atomic radius change from top to bottom within a group?
- Explain why the atomic radius of hydrogen is so much smaller that the atomic radius for potassium.