Frühe Ideen zur Materie: Von Demokrit bis Dalton
Moderne Atomtheorie

Priestley, Lavoisier und andere hatten die Grundlagen für die Chemie gelegt. Ihre Experimente zeigten, dass sich einige Stoffe mit anderen zu neuen Materialien verbinden können, dass andere Stoffe in einfachere zerlegt werden können und dass einige wenige Schlüsselelemente nicht weiter zerlegt werden können. Doch wie ließen sich diese komplexen Beobachtungen erklären? John Dalton, ein außergewöhnlicher britischer Lehrer und Wissenschaftler, setzte die Teile zusammen und entwickelte 1803 die erste moderne Atomtheorie. Um mehr über Priestleys und Lavoisiers Experimente zu erfahren und darüber, wie sie die Grundlage für Daltons Theorien bildeten, können Sie das unten verlinkte interaktive Experiment Dalton’s Playhouse ausprobieren.
Dalton machte es sich zur Gewohnheit, das Wetter in seiner Heimatstadt Manchester, England, zu beobachten und aufzuzeichnen. Durch seine Beobachtungen von Morgennebel und anderen Wettermustern erkannte Dalton, dass Wasser als Gas existieren kann, das sich mit Luft vermischt und denselben Raum wie Luft einnimmt. Feste Stoffe können nicht denselben Raum einnehmen wie andere; Eis zum Beispiel kann sich nicht mit Luft vermischen. Wie kann es also sein, dass sich Wasser manchmal wie ein Feststoff und manchmal wie ein Gas verhält? Dalton erkannte, dass alle Materie aus winzigen Teilchen bestehen muss. Im Gaszustand schwebten diese Teilchen frei umher und konnten sich mit anderen Gasen vermischen, wie Bernoulli vorgeschlagen hatte. Dalton dehnte diese Idee jedoch auf die gesamte Materie aus – Gase, Feststoffe und Flüssigkeiten. Dalton schlug einen Teil seiner Atomtheorie erstmals 1803 vor und verfeinerte diese Konzepte später in seinem klassischen Werk A New System of Chemical Philosophy von 1808 (das Sie über einen Link unter der Registerkarte Ressourcen aufrufen können).
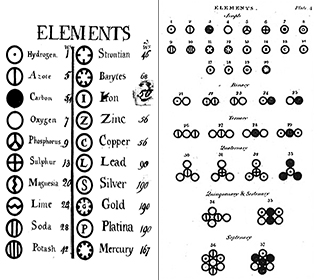
Daltons Theorie hatte vier Hauptkonzepte:
-
Alle Materie setzt sich aus unteilbaren Teilchen zusammen, die Atome genannt werden. Bernoulli, Dalton und andere stellten sich Atome als winzige, billardkugelartige Teilchen in verschiedenen Bewegungszuständen vor. Dieses Konzept ist zwar nützlich, um Atome zu verstehen, aber es ist nicht korrekt, wie wir in späteren Modulen zur Atomtheorie sehen werden, die am Ende dieses Moduls verlinkt sind.
-
Alle Atome eines bestimmten Elements sind identisch; Atome verschiedener Elemente haben unterschiedliche Eigenschaften. Daltons Theorie besagte, dass jedes einzelne Atom eines Elements, wie z.B. Sauerstoff, mit jedem anderen Sauerstoffatom identisch ist; darüber hinaus sind Atome verschiedener Elemente, wie z.B. Sauerstoff und Quecksilber, voneinander verschieden. Dalton charakterisierte die Elemente nach ihrem Atomgewicht; als jedoch in den späten 1800er Jahren Isotope der Elemente entdeckt wurden, änderte sich dieses Konzept.
-
Chemische Reaktionen beinhalten die Kombination von Atomen, nicht die Zerstörung von Atomen. Atome sind unzerstörbar und unveränderlich, so dass Verbindungen wie Wasser und Quecksilbercalx entstehen, wenn sich ein Atom chemisch mit anderen Atomen verbindet. Für die damalige Zeit war dies ein äußerst fortschrittliches Konzept; Daltons Theorie implizierte zwar, dass sich Atome miteinander verbinden, aber es sollte noch mehr als 100 Jahre dauern, bis Wissenschaftler begannen, das Konzept der chemischen Bindung zu erklären.
-
Wenn Elemente reagieren, um Verbindungen zu bilden, reagieren sie in bestimmten, ganzzahligen Verhältnissen. Die Experimente, die Dalton und andere durchführten, zeigten, dass Reaktionen keine zufälligen Ereignisse sind, sondern nach präzisen und wohldefinierten Formeln ablaufen. Auf dieses wichtige Konzept in der Chemie wird im Folgenden näher eingegangen.
Verständnis-Checkpoint
Ein Element besteht aus
Ein paar Details von Daltons Atomtheorie bedürfen einer genaueren Erklärung.
Elemente: Bereits 1660 erkannte Robert Boyle, dass die griechische Definition der Elemente (Erde, Feuer, Luft und Wasser) nicht korrekt war. Boyle schlug eine neue Definition eines Elements als Grundstoff vor, und wir definieren Elemente heute als Grundstoffe, die auf chemischem Wege nicht weiter zerlegt werden können. Elemente sind die Bausteine des Universums. Sie sind reine Substanzen, die die Grundlage für alle Materialien um uns herum bilden. Einige Elemente können wir in reiner Form sehen, wie Quecksilber in einem Thermometer; andere sehen wir hauptsächlich in chemischer Verbindung mit anderen, wie Sauerstoff und Wasserstoff in Wasser. Wir kennen heute etwa 116 verschiedene Elemente. Jedes dieser Elemente hat einen Namen und eine ein- oder zweibuchstabige Abkürzung. Oft ist diese Abkürzung einfach der erste Buchstabe des Elements, z. B. Wasserstoff mit H und Sauerstoff mit O. Manchmal wird ein Element mit zwei Buchstaben abgekürzt, z. B. Helium mit He. Wenn man die Abkürzung für ein Element schreibt, wird der erste Buchstabe immer groß geschrieben und der zweite Buchstabe (wenn es einen gibt) immer klein.
Atome: Eine einzelne Einheit eines Elements wird als Atom bezeichnet. Das Atom ist die grundlegendste Einheit der Materie, aus der alles in der Welt um uns herum besteht. Jedes Atom besitzt alle chemischen und physikalischen Eigenschaften seines Stammelements. Jahrhunderts wiesen Wissenschaftler nach, dass Atome in Wirklichkeit aus kleineren, „subatomaren“ Teilen bestehen, was das Konzept des Atoms als Billardkugel über den Haufen warf (siehe unser Modul Atomtheorie I: Die Anfänge).
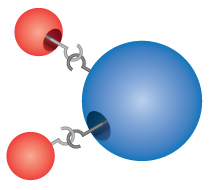
Verbindungen: Die meisten Materialien, mit denen wir in Berührung kommen, sind Verbindungen, also Stoffe, die durch die chemische Verbindung von zwei oder mehr Atomen der Elemente entstehen. Ein einzelnes „Teilchen“ einer Verbindung wird als Molekül bezeichnet. Dalton stellte sich fälschlicherweise vor, dass sich Atome zu Molekülen „verhaken“. Dalton erkannte jedoch richtig, dass Verbindungen genaue Formeln haben. Wasser zum Beispiel besteht immer aus zwei Teilen Wasserstoff und einem Teil Sauerstoff. Die chemische Formel einer Verbindung wird geschrieben, indem die Symbole der Elemente ohne Zwischenräume aneinandergereiht werden. Enthält ein Molekül mehr als ein Atom eines Elements, wird hinter dem Symbol eine Zahl eingefügt, die die Anzahl der Atome dieses Elements im Molekül angibt. So lautet die Formel für Wasser H2O, niemals HO oder H2O2.
Comprehension Checkpoint
The formula for water can be written as either H2O or HO2.