Frontiers in Neurology
Einführung
Die beidseitige Horizontalblicklähmung ist eine seltene Erscheinung, die durch eine beidseitige Unterbrechung des medianen longitudinalen Faszikulus, des Nucleus abducens oder der paramedianen pontinen retikulären Formation (PPRF) verursacht wird (1, 2). Zu den Arten von Augenbewegungen, die bei Hirnstammläsionen beeinträchtigt sein können, gehören horizontale und vertikale langsame Augenbewegungen, Verfolgungsbewegungen, vestibuläre und optokinetische Reaktionen sowie schnelle Augenbewegungen, einschließlich willkürlicher oder evozierter Sakkaden und schneller Phasen vestibulärer und optokinetischer Reize. Die Vergenzkontrolle kann durch Läsionen des Mittelhirns beeinträchtigt werden.
Horizontale Blicklähmung wurde als Folge eines Infarkts (3), einer Entzündung/Demyelinisierung im Rahmen von Multipler Sklerose (MS) oder Neuromyelitis optica spectrum disorders (NMOSD) (2, 4, 5), einer Blutung (6) und einer Metastasierung (7) beschrieben. Von den bisher berichteten nicht vaskulären/tumorbedingten Fällen wiesen fünf von sechs bilaterale horizontale Blicklähmungen auf, und drei hatten solitäre Läsionen in der Magnetresonanztomographie (MRT), die im pontinen Tegmentum lokalisiert waren. Milea et al. (1) berichteten über zwei Fälle von bilateraler internukleärer Ophthalmoplegie (INO), die sich in bilaterale horizontale Blicklähmungen mit einzelnen T2-anreichernden Läsionen an der gleichen Stelle und mit der gleichen Morphologie wie in unserer Fallserie verwandelte. Sie schlugen MS als wahrscheinliche Diagnose vor.
Henderson beschrieb einen Patienten mit horizontaler Diplopie beim linken Seitenblick und Adduktionsschwäche (8). Die MRT des Gehirns zeigte eine solitäre T2-hyperintense Hirnstammläsion neben dem vierten Ventrikel, und es wurde die Diagnose MS gestellt. Da keine zusätzlichen klinischen Informationen vorliegen, ist es schwierig zu erkennen, wie diese Diagnose gestellt wurde. Matsui et al. berichteten über einen Patienten, der über horizontale Diplopie mit beidseitiger horizontaler Blickparese klagte (9). Die Diagnose einer Bickerstaff’schen Hirnstammenzephalitis (BBE) wurde gestellt, obwohl die klinischen Merkmale nicht mit den diagnostischen Kriterien übereinstimmten (10).
Hier beschreiben wir drei Patienten mit beidseitiger horizontaler Blickparese, die in jedem Fall durch eine einsame, entzündliche Läsion verursacht wurde, die das dorsale Tegmentum des Pons betraf und sich nach vorne in die Region des medianen longitudinalen Fasciculus (MLF) erstreckte. Wir glauben, dass diese drei Fälle Fragen bezüglich der Pathogenese solcher Syndrome und der Beziehung zwischen horizontaler und vertikaler blickbezogener Projektion in den MLF im Besonderen aufwerfen.
In Übereinstimmung mit den ethischen Anforderungen unserer Einrichtung, dem Royal Melbourne Hospital, wurde von allen Patienten eine schriftliche Einwilligung zur Verwendung anonymisierter Daten eingeholt.
Patient 1
Ein 38-jähriger Mann türkischer Herkunft stellte sich mit akuter intermittierender Diplopie, Schwindel und Erbrechen vor; er wurde mit peripherem Schwindel diagnostiziert und entlassen. Eine Woche später stellte er sich erneut mit Taubheitsgefühlen im linken Gesicht vor. Seine persönliche Anamnese, die Untersuchung des Systems und die Familienanamnese waren unauffällig.
Die Sehschärfe betrug 0,63 OU, gemessen auf der Dezimalskala. Der Pupillendurchmesser betrug beidseitig 5 mm und war nicht reaktiv. Die Untersuchung der Augenmotilität (Tabelle 1) ergab einen vollständigen Ausfall aller horizontalen Augenbewegungen, der willkürlichen Sakkaden, der glatten Verfolgung, der vestibulären und der optokinetischen Bewegungen. Vertikale Sakkaden, Smooth Pursuit und vestibuläre Bewegungen waren bei der klinischen Untersuchung intakt, was jedoch die Möglichkeit einer geringfügigen Verlangsamung nicht ausschließt, die zur Identifizierung eine Okulographie erfordert hätte. Die neurologische Untersuchung war ansonsten normal.
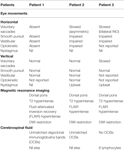
Tabelle 1. Zusammenfassung der klinischen okulomotorischen Befunde, der MRT-Befunde und der Liquor-Ergebnisse.
Die MRT des Gehirns zeigte eine hyperintense dreieckige T2- und FLAIR-Läsion in der dorsalen Pons im Boden des vierten Ventrikels (Abbildung 1A). Die Läsion wies eine leicht eingeschränkte Diffusion auf, die mit dem scheinbaren Diffusionskoeffizienten-Mapping übereinstimmte, was mit Berichten in der Literatur über entzündliche/demyelinisierende Läsionen (11, 12) übereinstimmt, und wies keine Kontrastverstärkung auf. Die MRT des Gehirns und der Wirbelsäule war ansonsten unauffällig. Die Hirnstammläsion wies Merkmale auf, die auf eine Demyelinisierung schließen ließen, obwohl keine weiteren Läsionen zu sehen waren. Als Differentialdiagnosen wurden Morbus Behçet, Vaskulitis oder eine mitotische Läsion in Betracht gezogen.
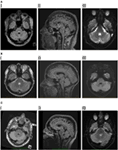
Abbildung 1. (A) I. Patient 1, axiale fluid-attenuated inversion recovery (FLAIR) mit hyperintenser Läsion im posterioren pontinen Tegmentum. II. Saggitales FLAIR mit vertikaler Ausdehnung der Läsion. III. Diffusionsgewichtete Bildgebung mit leichter Diffusionseinschränkung. (B) I. Patient 2, axiales Dualbild mit hyperintenser Läsion im posterioren pontinen Tegmentum. II. Saggitales FLAIR mit vertikaler Ausdehnung der Läsion. III. Diffusionsgewichtete Bildgebung mit leichter Diffusionseinschränkung. (C) I. Patient 3, axiales Flair mit hyperintenser Läsion im posterioren pontinen Tegmentum, rechts etwas stärker ausgeprägt. II. Saggitales FLAIR zeigt die vertikale Ausdehnung der Läsion, etwas größer als bei den beiden vorherigen Patienten, was mit einer gewissen Verlangsamung der vertikalen Sakkaden einhergeht. III. Die diffusionsgewichtete Bildgebung zeigt eine leichte Diffusionseinschränkung.
Die Analyse der Liquorflüssigkeit (CSF) ergab drei Lymphozyten, keine polymorphen und keine roten Blutkörperchen, oligoklonale Immunglobulinbanden (OCBs) wurden im Liquor gesehen und waren im Serum unauffällig. Der Eiweißgehalt war geringfügig erhöht (0,46 g/l), der Test auf Anti-Aquaporin 4 (Aq4) war jedoch negativ. Der Serum-Aq4-Test war ebenfalls negativ. Ein Test auf Anti-Gangliosid-Antikörper wurde nicht durchgeführt, und Anti-Myelin-Oligodendrozyten-Glykoprotein (MOG)-Antikörper waren zum Zeitpunkt der akuten Erkrankung nicht verfügbar, waren aber negativ, als sie zwei Jahre später verfügbar wurden.
Der Patient wurde wegen einer vermuteten Demyelinisierung behandelt und verbesserte sich nach einer dreitägigen intravenösen Gabe von 1 g Methylprednisolon (IV). Seine neurologische Untersuchung war bei der Nachuntersuchung 3 Wochen nach der Entlassung wieder normal. Serielle MRT-Untersuchungen des Gehirns zeigten eine vollständige Auflösung der pontinen Läsion, wobei keine neuen Läsionen zu sehen waren und in den 2 Jahren seit der Erstvorstellung keine weiteren klinischen Episoden auftraten.
Patientin 2
Eine 46-jährige Frau mit frontalen Kopfschmerzen wurde wegen Migräne behandelt und sprach zunächst auf Naproxen und Amitriptylin an. Sechs Tage später stellte sie sich erneut mit einer Verschlimmerung der Kopfschmerzen, Photophobie, verschwommenem Sehen, intermittierender horizontaler Diplopie und fluktuierendem Taubheitsgefühl im Gesicht vor.
Die Anamnese und die Familiengeschichte waren unauffällig. Die neuro-ophthalmologische Untersuchung ergab eine Sehschärfe von 0,32 OU. Die Pupillenreaktion wurde als leicht verlangsamt, aber beidseitig reaktiv beschrieben. Die okulomotorische Untersuchung ist in Tabelle 1 zusammengefasst. Es bestand eine asymmetrische beidseitige horizontale Blickparese, rechts schlimmer als links. Sakkaden nach rechts waren in der Amplitude eingeschränkt und langsam. Die vestibulären Reaktionen waren asymmetrisch, wobei die durch das Puppenkopfmanöver evozierten Augenbewegungen am linken Auge normal, am rechten Auge jedoch eingeschränkt waren. Aktivere Kopfstoßantworten waren beidseitig hypoaktiv. Der Aufwärtsnystagmus war am deutlichsten beim Aufwärtsblick, wurde aber bei der Ophthalmoskopie auch in der Primärposition festgestellt. Vertikale Sakkaden, aufwärts und abwärts, waren normal. Das vertikale Smooth Pursuit schien intakt zu sein. Vertikale Kopfstöße und optokinetische Reaktionen waren klinisch normal. Eine Video-Okulographie war nicht verfügbar, und insgesamt wurden diese Befunde als konsistent mit einer leichten Beeinträchtigung des vertikalen Blicks interpretiert. Der vertikale Nystagmus verschwand innerhalb von 2 Tagen. Außerdem hatte sie eine leichte beidseitige Gesichtsschwäche, fehlende Sehnenreflexe in den oberen Gliedmaßen und eine leichte Gangataxie. Der klinische Eindruck war, dass ihre Symptomkonstellation mit dem Miller-Fisher-Syndrom, der BBE oder einer zentralen Demyelinisierung übereinstimmte, ohne dass die Diagnose dieser Entitäten durch Tests bestätigt werden konnte.
Die Magnetresonanztomographie des Gehirns zeigte einen einsamen, gut definierten paramedianen Fokus mit T2-Hyperintensität in der dorsalen Pons, der eine leicht eingeschränkte Diffusion, aber keine Kontrastmittelanreicherung aufwies (Abbildung 1B). Die MRT-Wirbelsäule war normal.
Nervenleitfähigkeitsstudien zeigten eine beidseitige motorische axonale Neuropathie im Gesicht. Die Liquoranalyse ergab OCBs (nicht angepasst) und erhöhtes Albumin (298 mg/l). Der Aq4-Antikörper im Serum war negativ. Die Routineergebnisse des Liquors waren normal, einschließlich Eiweiß 0,4 g/l, Anzahl der weißen Zellen (WCC) und Anzahl der roten Zellen (RCC) < 1. Der Liquor war negativ für Anti-AQP4-, Anti-GM1-, Anti-GQ1B- und Anti-Myelin-Oligodendrozyten-Protein-Antikörper.
Die Diagnose lautete auf eine lokalisierte Enzephalitis, die auf die Pons beschränkt war und hauptsächlich das dorsale Tegmentum betraf. Der Patient wurde mit einer 5-tägigen Behandlung mit 2 g/kg IV Immunglobulin behandelt. Im Laufe der nächsten Woche besserte sich die Ophthalmoplegie deutlich, die Reflexe der oberen Gliedmaßen verbesserten sich und die Ataxie verschwand. Während der 12-monatigen Nachbeobachtung wurden keine neuen Symptome oder Läsionen festgestellt. Die Nachuntersuchung nach 18 Monaten bestätigte die vollständige klinische Genesung.
Patient 3
Dieser 29-jährige Mann erwachte mit Schweißausbrüchen und Schüttelfrost, gefolgt von bifrontalen Kopfschmerzen, Lagerungsschwindel, Übelkeit und Erbrechen. Bei seiner Vorstellung 12 Stunden später hatte er eine horizontale Diplopie und ein rechtsseitiges Taubheitsgefühl. Er gab eine 5-tägige Anamnese mit Symptomen der oberen Atemwege, verstopften Nasennebenhöhlen und einer Keuchhustenimpfung 1 Monat vor dem Auftreten der Symptome an. In der Anamnese wurden Bluthochdruck, Hypothyreose, Angstzustände, Reizdarmsyndrom, Adipositas und nichtalkoholische Steatohepatitis angegeben.
Die Magnetresonanztomographie des Gehirns zeigte eine linksseitige, nicht verstärkende, T2-hyperintense dorsale pontine Läsion, die eine eingeschränkte Diffusion aufwies (Abbildung 1C). Der Liquor wies eine erhöhte WCC von 8 × 106/l (7 Lymphozyten, 1 Neutrophiler) auf, die RCC betrug 4 × 106/l und das Liquorprotein lag bei 0,35 g/l. In einer anderen Einrichtung wurde zunächst ein ischämischer Schlaganfall diagnostiziert, und es wurde eine medikamentöse Therapie zur Sekundärprävention eingeleitet. Bei der Magnetresonanzangiographie, dem Herzmonitoring, dem transösophagealen Echokardiogramm, den Vaskulitis- und Thrombophilie-Screenings wurden keine Anomalien festgestellt.
Zwei Wochen nach Beginn der Erkrankung entwickelte er einen veränderten linksseitigen Geschmack, eine linke Zunge, eine innere Mundhöhle und ein Taubheitsgefühl im Gesicht. Seine monokulare Sehschärfe betrug 1,0 OU, aber die dynamische Sehschärfe lag bei 0,4 OU. Die Reaktionen der Pupillen waren normal. Er zeigte eine beidseitige Blickparese und INO (Tabelle 1). Die Kopfstoßreaktionen waren beidseitig hypoaktiv mit leicht verlangsamten Aufwärtssakkaden und Aufwärtsnystagmus beim Aufblicken. Die übrige neurologische Untersuchung ergab nur eine leichte linksseitige Dysmetrie.
Die erneute Liquoranalyse ergab 3 Leukozyten (undifferenziert), 27 Erythrozyten und einen negativen Befund für OCBs. Die kontrastfreie MRT des Gehirns zeigte eine Vergrößerung der Läsion mit anhaltender eingeschränkter Diffusion. Das Erscheinungsbild wurde mit einer Demyelinisierung in Verbindung gebracht. Anti-Gangliosid-Antikörper im Serum, Anti-Aquaporin-4-Antikörper (AQP4) und Anti-MOG-Antikörper waren negativ.
Er wurde mit einer dreitägigen Behandlung mit täglich 1 g Methylprednisolon i.v., gefolgt von täglich 60 mg oralem Prednisolon, behandelt, die nach einem Monat langsam abgesetzt wurde. Bei einer Nachuntersuchung 8 Wochen nach der Erstvorstellung wurden nur noch ein linkes INO und rechte sensorische Symptome festgestellt, die sich in den folgenden Monaten zurückbildeten. Bei der Nachuntersuchung 3 Monate später bildete sich die Läsion vollständig zurück.
Diskussion
Wir beschreiben drei Fälle von beidseitiger horizontaler Blickparese, die mit der akuten Entwicklung einer kleinen, gut umschriebenen Läsion des pontinen Tegmentums im MRT zusammenfiel. Definitionsgemäß handelt es sich bei diesen Fällen um klinisch isolierte Syndrome, bei denen jedoch nach 12-36 Monaten keine rezidivierenden Läsionen auftraten. Der Phänotyp ist bei MS, NMOSD, Schlaganfall und Tumor beschrieben (1, 4, 5, 8, 9, 13, 14). Patienten mit diesen Diagnosen neigen jedoch dazu, Schübe und charakteristische MRT-Veränderungen zu entwickeln (4, 15). In unseren Fällen gibt es keine ausreichenden Beweise für eine dieser Diagnosen bei der Vorstellung oder bei der Nachuntersuchung. Wir konzentrieren uns hier auf die vorgeschlagenen klinischen und anatomischen Neuerungen, die sie aufweisen.
Anti-GQ1b-Spektrum-Störungen können Augenbewegungen beeinträchtigen und könnten möglicherweise die von uns beschriebenen klinischen Merkmale aufweisen. Im zweiten Fall wurde ein Miller-Fisher/BBE-Überlappungssyndrom in Erwägung gezogen, aber diese Patienten weisen in der Regel positive Anti-GQ1B-Antikörper und ein normales MRT des Gehirns auf (13). Daher halten wir eine andere Diagnose für wahrscheinlicher. Obwohl bei NMOSD entzündliche Läsionen in der Nähe des pontinen Tegmentums auftreten können, liegen sie typischerweise etwas tiefer am Boden des vierten Ventrikels. Die hier berichteten Fälle erfüllen nicht die kürzlich aktualisierten Kriterien für NMOSD (16).
Auch das CLIPPERS-Syndrom ist eine entzündliche Störung des Hirnstamms, ist aber klinisch und radiologisch diffuser und dürfte bei unseren Patienten keine Erklärung sein (17).
Die Kontrolle des vertikalen Blicks wird im Allgemeinen dem rostralen Mittelhirn, dem rostralen interstitiellen Kern des MLF (riMLF), der Burst-Zellen enthält, und dem interstitiellen Kern von Cajal zugeschrieben, der den neuralen Integrator für die Aufrechterhaltung der Position in der Augenhöhle bildet. Diese Regionen projizieren beidseitig, teilweise über die hintere Kommissur. Die Eingänge zu diesen Arealen stammen aus einer Reihe von Quellen, die teilweise von der Art des Eingangs abhängen.
Vestibuläre Eingänge stammen von den oberen vestibulären Kernen auf beiden Seiten, während Smooth-Pursuit-Signale von der Y-Zellgruppe zum riMLF projiziert werden. Zu den Leitungsbahnen gehören die MLF, der ventrale Tegmentaltrakt und die Kleinhirnbahnen. Freiwillige und reflexive vertikale Sakkaden, die von supratentoriellen Netzwerken bestimmt werden, scheinen von Projektionen aus der PPRF-Region auf beiden Seiten abhängig zu sein und werden durch lokalisierte Läsionen der kaudalen PPRF auf beiden Seiten aufgehoben (18). Es wurde eine starke Projektion von Omnipause-Neuronen von der PPRF bilateral zur riMLF nachgewiesen (19, 20). Diese müssen gehemmt werden, damit willkürliche und reflexive Sakkaden, nicht aber schnelle Phasen, generiert werden können (21).
Der vertikale Blick kann bei Vorliegen einer horizontalen Ophthalmoplegie mit einer posterioren pontinen tegmentalen Läsion mit oder ohne weitergehende Pathologie verschont bleiben (1, 13). Obwohl reine Abducens-Läsionen zu einer horizontalen Blicklähmung führen können, traten in den von Milea et al. berichteten Fällen schon früh bilaterale INO auf, was auf eine Beteiligung entweder der MLF oder bilateraler Projektionen in die MLF hindeutet.
Die vereinigende Läsion bei unseren und den hier genannten Patienten ist die hintere tegmentale Läsion. Diese Läsion befindet sich in unmittelbarer Nähe zu den Nuclei abducens und zur PPRF, die die erregenden Burst-Zellen für den horizontalen Blick enthält. Eine bilaterale Beteiligung von Projektionen aus dem PPRF oder den Abducenskernen würde die Lähmung des horizontalen Blicks erklären. Die relative Schonung der vertikalen Augenbewegungen deutet darauf hin, dass die bilateralen vertikalen Signale, die über die MLF (22) in das vertikale Blickzentrum der mesenzephalen retikulären Formation projiziert werden, im Vergleich zu den seitlichen Blickeingängen über einen anderen Weg in der Pons laufen. Dies steht im Einklang mit den Erkenntnissen von Pierrot-Deseilligny et al. (7) über dissoziierte bilaterale Lähmungen des horizontalen Blicks, widerspricht jedoch der gegenwärtigen konventionellen klinischen Wahrnehmung der Anatomie in diesem Bereich.
Wenn es bilaterale Läsionen der lateralen Blickzentren in der PPRF gibt, die eng mit dem Nucleus abducens assoziiert und von diesem kaum zu unterscheiden sind, würde die konventionelle Weisheit darauf hindeuten, dass es auch vertikale Blicklähmungen geben sollte, da diese Bahnen zusammen verlaufen sollen. Sicherlich führen Läsionen der Mittellinie, die beide medianen longitudinalen Faszikel (MLF) betreffen, zu einer bilateralen INO, die typischerweise mit einer vertikalen Blickparese einhergeht, die durch eine Beeinträchtigung des vertikalen Smooth Pursuit und eine Aufhebung des vestibulo-okularen Reflexes gekennzeichnet ist (23). Weiter rostral gelegene Läsionen können Mittelhirnstrukturen (riMLF und INC) betreffen, die an vertikalen Sakkaden beteiligt sind (24). Bei unseren Patienten wurde keine derartige Beeinträchtigung des vertikalen Blicks festgestellt.
Wir vermuten, dass die vertikalen und horizontalen Blickbahnen in ihrem unteren Verlauf getrennt verlaufen und in ihrem rostralen Verlauf zusammenlaufen, wobei die vertikalen Blickeingänge anterolateral zu den horizontalen Blickeingängen verlaufen. Wahrscheinlich kreuzen sie sich auf ihrem Weg nach oben, so dass bilaterale Läsionen erforderlich sind, um eine Lähmung des vertikalen Blicks zu verursachen. Dies würde erklären, warum der direkte Pfad für den vertikalen Blick vom lateralen PPRF bei einer einseitigen Läsion verschont bleibt, vertikale Augenbewegungen bei bilateralen lokalisierten Läsionen verschwinden und bilaterale Stimulationen erforderlich sind, um vertikale Augenbewegungen auszulösen (18, 22).
Wir schlagen eine leicht veränderte anatomische Anordnung vor, um dies darzustellen (Abbildung 2). Die horizontalen Blickbahnen projizieren zum ipsilateralen Nucleus abducens und steigen dann in der MLF zum kontralateralen Subnucleus rectus medialis des dritten Nervenkerns auf. Wir vermuten, dass das vertikale Blicksignal weiter anterior in die MLF projiziert und zumindest über eine kurze Strecke von den horizontalen Blickfaserbahnen trennbar ist.
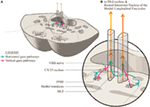
Abbildung 2. (A) Ein Schnitt durch die Mittelkonsole, der die Beziehung der paramedianen pontinen retikulären Formation zum medianen longitudinalen Faszikulus (MLF) und dem angrenzenden siebten Hirnnerven zeigt, wie er um den Nucleus abducens herum verläuft. (B) Eine Vergrößerung, die die vorgeschlagene Konformation der getrennten horizontalen und vertikalen Blickpfade zeigt, wie sie in den MLF projiziert werden. Das horizontale Signal dekussiert auf der Ebene der Pons und steigt in der kontralateralen MLF auf, während es ungewiss ist, ob das vertikale Blicksignal überhaupt dekussiert oder eine direkte Projektion ist.
Die Ähnlichkeiten im Phänotyp und in der Morphologie der kausalen Läsionen in diesen Fällen legen nahe, dass diese Region des pontinen Tegmentums besondere Merkmale aufweist, die sie anfällig für immunologische Angriffe machen. Keiner dieser Fälle erfüllt die Kriterien für andere entzündliche oder andere Krankheiten, die mit einer MLF-Beteiligung assoziiert sind.
Wenn diese Fälle tatsächlich einen neuartigen Phänotyp darstellen, muss die optimale Behandlung sowohl in der akuten Phase als auch auf lange Sicht bestimmt werden. Eine Fehldiagnose, z. B. bei MS oder Schlaganfall, birgt die Gefahr, dass der Patient einer unnötigen Langzeitbehandlung mit Thrombozytenaggregationshemmern oder immunmodulierenden Medikamenten ausgesetzt wird und Angst vor der Diagnose einer schwerwiegenden, möglicherweise wiederkehrenden Langzeiterkrankung hat, die sich nachteilig auf seine Lebensentscheidungen und -möglichkeiten auswirkt.
Die Identifizierung anderer Fälle dieses Phänotyps wäre nützlich, um die Suche nach spezifischen neuen Antikörpern zu erleichtern, die hier eine Rolle spielen könnten, und um den geeignetsten und wirksamsten Behandlungsverlauf zu ermitteln.
Beiträge der Autoren
RE überprüfte die Patientenakten und die Bildgebung, sammelte die Daten und erstellte die vorläufigen Präsentationen und trug zur laufenden Bearbeitung des endgültigen Manuskripts bei. OW beaufsichtigte RE bei der Datenerhebung und war auf allen Ebenen an der Erstellung und Interpretation der Daten sowie an der Überprüfung und Bearbeitung des endgültigen Manuskripts beteiligt. AB arbeitete mit RE bei der Analyse der Daten, der Durchsicht der relevanten Literatur, der Interpretation der Ergebnisse und der Erstellung des Manuskripts zusammen.
Erklärung zu Interessenkonflikten
Diese Forschung wurde nicht durch kommerzielle Interessen finanziell unterstützt. Es bestehen keine finanziellen Beziehungen, die als potenzieller Interessenkonflikt ausgelegt werden könnten.
1. Milea D, Napolitano M, Dechy H, Le Hoang P, Delattre J-Y, Pierrot-Deseilligny C. Komplette bilaterale horizontale Blicklähmung bei Multipler Sklerose. J Neurol Neurosurg Psychiatry (2001) 70(2):252-5. doi:10.1136/jnnp.70.2.252
PubMed Abstract | CrossRef Full Text | Google Scholar
2. Tan E, Kansu T. Bilateral horizontal gaze palsy in multiple sclerosis. J Clin Neuroophthalmol (1990) 10(2):124–6.
Google Scholar
3. Kataoka S, Hori A, Shirakawa T, Hirose G. Paramedian pontine infarction. Stroke (1997) 28(4):809–15. doi:10.1161/01.STR.28.4.809
CrossRef Full Text | Google Scholar
4. Furutani Y, Hata M, Miyamoto K, Moribata Y, Yoshimura N. A case of neuromyelitis optica masquerading as Miller Fisher syndrome. Case Rep Neurol (2014) 6(3):226–31. doi:10.1159/000368183
PubMed Abstract | CrossRef Full Text | Google Scholar
5. Ng AW, Teoh SC. Dengue eye disease. Surv Ophthalmol (2015) 60(2):106–14. doi:10.1016/j.survophthal.2014.07.003
PubMed Abstract | CrossRef Full Text | Google Scholar
6. Koehler PJ, Wattendorff AR, Goor C, Hekster REM, Falke THM. Bilateral horizontal gaze paralysis due to pontine hemorrhage. Clin Neurol Neurosurg (1986) 88(2):121–5. doi:10.1016/S0303-8467(86)80007-5
CrossRef Full Text | Google Scholar
7. Pierrot-Deseilligny C, Goasguen J, Chain F, Lapresle J. Pontine metastasis with dissociated bilateral horizontal gaze paralysis. J Neurol Neurosurg Psychiatry (1984) 47(2):159–64. doi:10.1136/jnnp.47.2.159
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Henderson S. A young patient with visual disturbance. Eur J Intern Med (2014) 25(6):e69–70. doi:10.1016/j.ejim.2014.05.007
CrossRef Full Text | Google Scholar
9. Matsui TA, Mineta H, Shioyama S, Kihara M, Takahashi M. . Clin Neurol (1998) 38(2):150–3.
Google Scholar
10. Bickerstaff ER. Brain-stem encephalitis; further observations on a grave syndrome with benign prognosis. Br Med J (1957) 1(5032):1384–7. doi:10.1136/bmj.1.5032.1384
CrossRef Full Text | Google Scholar
11. Schaefer PW, Grant PE, Gonzalez RG. Diffusion-weighted MR imaging of the brain. Radiology (2000) 217(2):331–45. doi:10.1148/radiology.217.2.r00nv24331
CrossRef Full Text | Google Scholar
12. Küker W, Ruff J, Gaertner S, Mehnert F, Mader I, Nägele T. Modern MRI tools for the characterization of acute demyelinating lesions: value of chemical shift and diffusion-weighted imaging. Neuroradiology (2004) 46(6):421-6. doi:10.1007/s00234-004-1203-5
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Kipfer S, Crook DW. Isolierte bilaterale horizontale Blicklähmung als Erstmanifestation der Multiplen Sklerose. Mult Scler J (2014) 20(6):754-5. doi:10.1177/1352458513518627
CrossRef Full Text | Google Scholar
14. Bronstein AM, Rudge P, Gresty MA, Du Boulay G, Morris J. Abnormalities of horizontal gaze. Klinische, okulographische und kernspintomographische Befunde. II. Blicklähmung und internukleäre Ophthalmoplegie. J Neurol Neurosurg Psychiatry (1990) 53(3):200–7. doi:10.1136/jnnp.53.3.200
CrossRef Full Text | Google Scholar
15. Wingerchuk DM, Lennon VA, Pittock SJ, Lucchinetti CF, Weinshenker BG. Revised diagnostic criteria for neuromyelitis optica. Neurology (2006) 66(10):1485–9. doi:10.1212/01.wnl.0000216139.44259.74
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Wingerchuk DM, Banwell B, Bennett JL, Cabre P, Carroll W, Chitnis T, et al. International consensus diagnostic criteria for neuromyelitis optica spectrum disorders. Neurology (2015) 85:177–89. doi:10.1212/WNL.0000000000001729
CrossRef Full Text | Google Scholar
17. Kira J. The expanding phenotype of CLIPPERS: is it a disease or a syndrome? J Neurol Neurosurg Psychiatry (2012) 83(1):2–3. doi:10.1136/jnnp-2011-301626
CrossRef Full Text | Google Scholar
18. Henn V, Lang W, Hepp K, Reisine H. Experimental gaze palsies in monkeys and their relation to human pathology. Brain (1984) 107(2):619–36. doi:10.1093/brain/107.2.619
PubMed Abstract | CrossRef Full Text | Google Scholar
19. Büttner-Ennever JA, Buttner U. A cell group associated with vertical eye movements in the rostral mesencephalic reticular formation of the monkey. Brain Res (1978) 151(1):31–47. doi:10.1016/0006-8993(78)90948-4
PubMed Abstract | CrossRef Full Text | Google Scholar
20. Horn AKE. The reticular formation. Prog Brain Res (2006) 151:127–55. doi:10.1016/S0079-6123(05)51005-7
CrossRef Full Text | Google Scholar
21. Nakao S, Shiraishi Y, Oda H, Inagaki M. Direct inhibitory projection of pontine omnipause neurons to burst neurons in the Forel’s field H controlling vertical eye movement-related motoneurons in the cat. Exp Brain Res (1988) 70(3):632–6. doi:10.1007
CrossRef Full Text | Google Scholar
22. Bender MB. Brain control of conjugate horizontal and vertical eye movements: a survey of the structural and functional correlates. Brain (1980) 103(1):23–69. doi:10.1093/brain/103.1.23
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Ranalli PJ, Sharpe JA. Vertical vestibulo-ocular reflex, smooth pursuit and eye-head tracking dysfunction in internuclear ophthalmoplegia. Brain (1988) 111(Pt 6):1299–317.
PubMed Abstract | Google Scholar
24. Bhidayasiri R, Plant GT, Leigh RJ. A hypothetical scheme for the brainstem control of vertical gaze. Neurology (2000) 54(10):1985–93.
PubMed Abstract | Google Scholar