Grundsätze der Biologie
Nachdem wir gelernt haben, dass bei chemischen Reaktionen Energie freigesetzt wird, wenn energiespeichernde Bindungen aufgebrochen werden, ist eine wichtige nächste Frage die folgende: Wie wird die mit diesen chemischen Reaktionen verbundene Energie quantifiziert und ausgedrückt? Wie kann die bei einer Reaktion freigesetzte Energie mit der einer anderen Reaktion verglichen werden? Zur Quantifizierung dieser Energieübertragungen wird eine Messung der freien Energie verwendet. Erinnern Sie sich daran, dass nach dem zweiten Hauptsatz der Thermodynamik alle Energieübertragungen mit dem Verlust einer gewissen Menge an Energie in einer unbrauchbaren Form wie Wärme einhergehen. Die freie Energie bezieht sich speziell auf die mit einer chemischen Reaktion verbundene Energie, die nach Berücksichtigung der Verluste zur Verfügung steht. Mit anderen Worten: Freie Energie ist nutzbare Energie oder Energie, die zur Verrichtung von Arbeit zur Verfügung steht. Betrachtet man dieses Konzept im biologischen Sinne, so ist die freie Energie die Energie innerhalb eines Moleküls, die zur Verrichtung von Arbeit genutzt werden kann. Glukose hat viel freie Energie, weil in den Bindungen des Glukosemoleküls viel Energie gespeichert ist. Kohlendioxid hat eine viel geringere freie Energie, weil in seinen Bindungen viel weniger Energie gespeichert ist.
Wird bei einer chemischen Reaktion Energie freigesetzt, so ist die Änderung der freien Energie bei der Umwandlung der Reaktanten in die Produkte, bezeichnet als ΔG (delta G), eine negative Zahl. Eine negative Änderung der freien Energie bedeutet auch, dass die Produkte der Reaktion eine geringere freie Energie haben als die Reaktanten, da sie während der Reaktion freie Energie abgeben. Reaktionen, die eine negative Änderung der freien Energie aufweisen und folglich freie Energie freisetzen, werden als exergonische Reaktionen bezeichnet. Exergonisch bedeutet, dass dem System Energie entzogen wird. Diese Reaktionen werden auch als Spontanreaktionen bezeichnet, und ihre Produkte haben weniger gespeicherte Energie als die Reaktanten. Eine wichtige Unterscheidung muss zwischen dem Begriff spontan und der Vorstellung, dass eine chemische Reaktion sofort abläuft, getroffen werden. Im Gegensatz zum alltäglichen Gebrauch des Begriffs ist eine spontane Reaktion keine Reaktion, die plötzlich oder schnell abläuft. Das Rosten von Eisen ist ein Beispiel für eine spontane Reaktion, die langsam, nach und nach, im Laufe der Zeit abläuft.
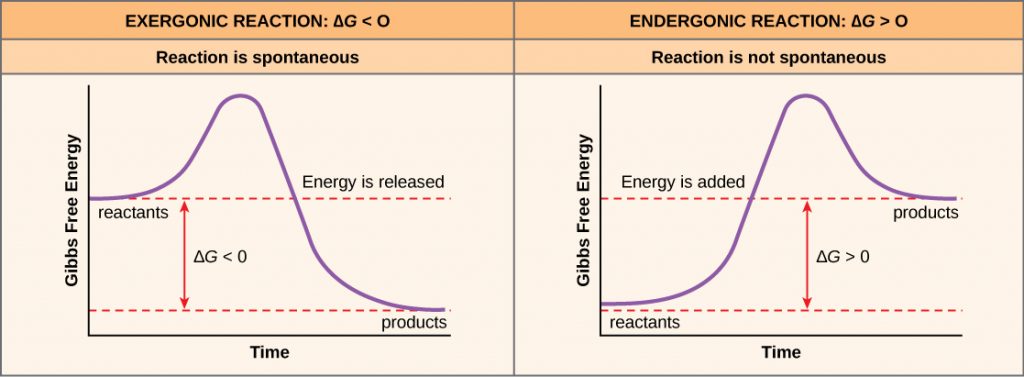
Wenn eine chemische Reaktion per Saldo eher Energie absorbiert als freisetzt, dann ist das ΔG für diese Reaktion ein positiver Wert. In diesem Fall haben die Produkte mehr freie Energie als die Reaktanten. Daher können die Produkte dieser Reaktionen als energiespeichernde Moleküle betrachtet werden. Diese chemischen Reaktionen werden als endergonische Reaktionen bezeichnet und laufen nicht spontan ab.
Eine endergonische Reaktion läuft nicht von selbst ab, ohne dass freie Energie zugeführt wird.

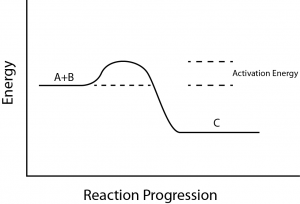
Es gibt noch ein weiteres wichtiges Konzept, das bei endergonischen und exergonischen Reaktionen berücksichtigt werden muss. Exergonische Reaktionen erfordern eine geringe Energiezufuhr, um in Gang zu kommen, bevor sie mit ihren energiefreisetzenden Schritten fortfahren können.
Diese Reaktionen haben eine Netto-Energiefreisetzung, erfordern aber dennoch eine gewisse Energiezufuhr am Anfang. Diese kleine Menge an Energie, die für alle chemischen Reaktionen erforderlich ist, wird als Aktivierungsenergie bezeichnet (Abbildung 3).
Wenn nicht anders angegeben, sind die Bilder auf dieser Seite unter CC-BY 4.0 von OpenStax lizenziert.
Text angepasst aus: OpenStax, Concepts of Biology. OpenStax CNX. May 18, 2016 http://cnx.org/contents/[email protected]