H2S Lewis Structure, Molecular Geometry, Hybridization and Polarity
Hydrogen Sulfide is a common chemical compound that is useful for analyzing inorganic compounds of metal ions. It has the chemical formula of H2S. The molecule has two Hydrogen atoms and a single Sulfur atom. H2S is also a precursor for elemental Sulfur. It also plays a vital role in signaling pathways in the human body. So to understand the hybridization, polarity, and molecular geometry of this compound, it is essential to know its Lewis structure.
| Name of molecule | Hydrogen Disulfide ( H2S) |
| No of Valence Electrons in the molecule | 8 |
| Hybridization of CO2 | sp3 hybridization |
| Bond Angles | 104.5 degrees |
| Molecular Geometry of CO2 | Bent |
Before knowing its Lewis structure, let us calculate the total number of valence electrons in Hydrogen Sulfide as these electrons participate in bond formation and help us study Lewis structure with ease.
Contents
Valence electrons of H2S
To know the total number of valence electrons in Hydrogen Sulfide we need to add the valence electrons of both Hydrogen and Sulfur atoms. There are two atoms of Hydrogen and a single atom of Sulfur in the compound.
Each Hydrogen atom has only one electron which is also its valence electron
Hence there are two valence electrons for Hydrogen atom ( as there are two Hydrogen atoms)
Sulfur has six valence electrons.
Total number of valence electrons in H2S
= 2(1) + 6
= 8
Thus, there are a total of eight valence electrons in H2S.
H2S-Lewis-Struktur
Die Lewis-Struktur einer Verbindung ist eine strukturelle Darstellung der Valenzelektronen, die an der Bildung einer Bindung beteiligt sind, sowie der nichtbindenden Elektronenpaare. Die Kenntnis der Lewis-Struktur einer bestimmten chemischen Verbindung ist wichtig, da sie die notwendigen Informationen über alle anderen chemischen Eigenschaften der Verbindung liefert.
Die Darstellung erfolgt durch Punkte und Linien, die Elektronen repräsentieren. Die Punkte stellen die Elektronen dar, die nicht an der Bindungsbildung beteiligt sind. Die Linien hingegen stellen die Bindungen in der Verbindung dar. Die Struktur wird auf der Grundlage der Oktett-Regel erstellt. Die Oktettregel der Chemie besagt, dass sich acht Elektronen in der äußeren Schale eines Elements befinden sollten, damit es stabil ist.
Die Lewis-Struktur von Schwefelwasserstoff ist einfach zu zeichnen und zu verstehen. In dieser Verbindung benötigen beide Wasserstoffatome ein Elektron, um die kovalente Bindung mit Schwefel einzugehen. Die Lewis-Struktur von H2S ist ähnlich wie die von H2S. Schwefel benötigt acht Elektronen, um die Anforderungen der Oktettregel zu erfüllen. Wasserstoff hingegen benötigt nur ein einziges Elektron, um stabil zu werden, da er zu den Elementen der Gruppe 1 gehört.
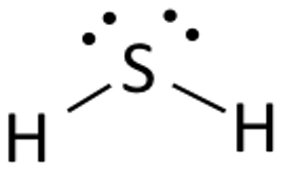
Platziere das Schwefelatom in der Mitte und ordne seine Valenzelektronen um es herum an.
Nun platziere zwei Wasserstoffatome zu beiden Seiten des Zentralatoms.
Hier werden die Valenzelektronen des Schwefels benutzt, um den Wasserstoff stabil zu machen, indem sie ein Elektron an beide Wasserstoffatome abgeben. Zwei der sechs Valenzelektronen sind an der Bindungsbildung beteiligt.
Zeichne Linien (zur Darstellung von Bindungen) zwischen Wasserstoff- und Schwefelatomen.
Die restlichen vier Elektronen sind Nichtbindungselektronen und werden daher als Punkte in der Nähe des Schwefelatoms dargestellt. Insgesamt gibt es in dieser Verbindung zwei Paare nichtbindender Elektronen und die Wasserstoffatome haben eine vollständige Valenzschale.
H2S-Hybridisierung
Um die Hybridisierung von H2S zu verstehen, muss man zunächst zwei Dinge wissen:
- Die Anzahl der Bindungen in der Verbindung und ihre Art
Um die Hybridisierung zu verstehen, muss man die Art der Bindungen in der Verbindung kennen. Im H2S-Molekül gehen zwei Wasserstoffatome eine Bindung mit dem zentralen Schwefelatom ein. In dem Molekül werden zwei Einfachbindungen gebildet. Diese Bindungen nehmen vier Valenzelektronen auf, so dass vier weitere Valenzelektronen übrig bleiben. Bei der Bildung einer Bindung überlappt sich das s-Orbital des Wasserstoffatoms mit dem p-Orbital des Schwefelatoms. Das einsame Elektronenpaar nimmt zwei der sp3-Orbitale ein. Die beiden anderen sp3-Orbitale überlappen sich mit dem 1s-Orbital des Wasserstoffatoms.
Diese Anordnung führt zur sp3-Hybridisierung des H2S-Moleküls. Die Überlappung der zwei Hybridorbitale bildet zwei Sigma-Bindungen zwischen Wasserstoff- und Schwefelatom.
- Die sterische Zahl der gegebenen Verbindung
Die sterische Zahl ist definiert als der Bereich der Elektronendichte um das Zentralatom. Da in diesem Fall Schwefel das Zentralatom ist, ergibt sich die Sterizahl der Verbindung aus der Summe der an das Zentralatom gebundenen Atome und der Anzahl der einsamen Elektronenpaare um das Zentralatom.
Die Formel zur Ermittlung dieser Zahl lautet:
Sterische Zahl (SN)
= Anzahl der Sigma-Bindungen am Zentralatom +Anzahl der Pi-Elektronenpaare am Zentralatom
In diesem Fall von H2S-Molekülen gibt es zwei Sigma-Bindungen und zwei einsame Elektronenpaare am Zentralatom.

Damit ist SN des H2S-Moleküls = 2+2
=4
Da die sterische Zahl von H2S vier ist, hat es zwei
Hybridorbitale und zwei einsame Elektronenpaare, die es zu einer sp3-Hybridisierung machen.
Nachdem wir nun die Lewis-Struktur und die Hybridisierung des Moleküls kennen, ist es einfach, seine Molekülgeometrie zu bestimmen.
H2S Molekülgeometrie
Die Hybridisierung des gegebenen Moleküls H2S ist sp3; das Schwefelatom befindet sich in zentraler Bindung mit zwei Wasserstoffatomen, die einen Bindungswinkel von weniger als 180 Grad bilden. Nach der VSEPR-Theorie stoßen sich die einsamen Elektronenpaare gegenseitig ab, aber da das Schwefelatom weniger elektronegativ ist, verringert sich der Bindungswinkel auf 104,5 Grad.
Diese Verringerung des Winkels führt zu einer gekrümmten Struktur.
Eine weitere Möglichkeit, die Molekülgeometrie zu bestimmen, ist die AXN-Methode. Dabei steht A für das Zentralatom, X für die Anzahl der gebundenen Elektronenpaare und N für die einsamen Elektronenpaare. In diesem Fall lautet die allgemeine Formel AX2N2, da es zwei Bindungspaare und zwei einsame Elektronenpaare gibt. Dieses Molekül weist also eine gebogene Geometrie auf.
H2S Polarität
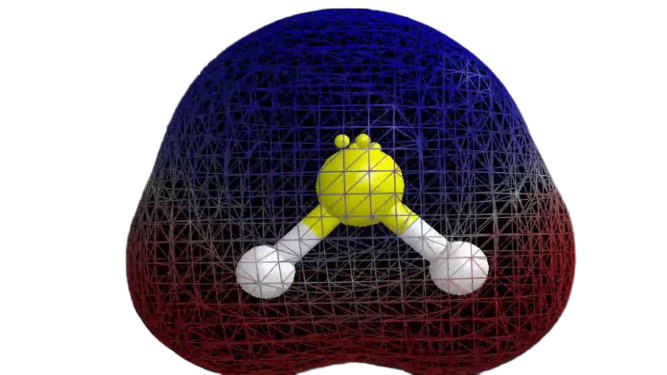
Nachdem wir nun die erforderlichen Informationen über das Molekül haben, ist es einfach, seine Polarität zu bestimmen. Die Polarität eines jeden Moleküls hängt von seiner Molekülgeometrie und der allgemeinen Elektronegativität ab. Da das Schwefelatom weniger elektronegativ ist, ist die Gesamtelektronegativität der Verbindung kleiner als 0,4, was sie unpolar macht.
Daher kann man sagen, dass das H2S-Molekül unpolar ist.
Abschließende Bemerkungen
Aus den obigen Informationen kann man schließen, dass das H2S-Molekül acht Valenzelektronen, sp3-Hybridisierung, gebogene Molekülgeometrie hat und unpolar ist.