Lyme Disease
Überblick
Der erste Fall von Anaplasmose beim Menschen wurde 1990 beschrieben, als ein Patient aus Wisconsin nach einem Zeckenbiss eine schwere fiebrige Erkrankung entwickelte und zwei Wochen später starb. In Blutausstrichen wurden Bakteriencluster in den neutrophilen Granulozyten des Patienten gefunden, die den Morulae in Monozyten bei einer E. chaffeensis-Infektion ähnelten. Die Kulturen und serologischen Tests auf E. chaffeensis waren jedoch negativ. Dennoch deutete der klinische Verlauf der Patientin auf eine Ehrlichiose hin, und als in den folgenden Jahren mehrere weitere Fälle der Krankheit im nördlichen Mittleren Westen gemeldet wurden, wurde die Vermutung geäußert, dass es sich um eine neue Ehrlichia-Art handeln könnte. Die neue Krankheit erhielt vorläufig den Namen „humane granulozytäre Ehrlichiose“ oder HGE.
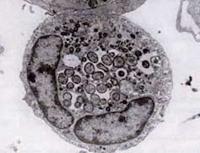
Im Jahr 1994 ergaben DNA-Sequenzierungsstudien, dass der HGE-Erreger sich eindeutig von E. chaffeensis unterscheidet, aber im Wesentlichen identisch ist mit zwei zuvor bekannten ehrlichen Tierkrankheitserregern, E. equi und E. (Cytoecetes) phagocytophila. Nach einem neuen taxonomischen Schema, das inzwischen eingeführt wurde, wurden diese drei Organismen als eine einzige Art in einer neuen Gattung, Anaplasma, zusammengefasst. Die neue Art wird als Anaplasma phagocytophilum bezeichnet, und die von ihr verursachte Krankheit ist jetzt als humane granulozytäre Anaplasmose (HGA) bekannt.
Wie Ehrlichia-Arten sind Anaplasma-Organismen klein, gramnegativ und intrazellulär. A. phagocytophilum zielt auf neutrophile Granulozyten, verändert deren Funktion im Wirt und bildet Morulae in Vakuolen. Die meisten der von ihm verursachten Schäden scheinen mit den Entzündungsprozessen des Wirts zusammenzuhängen, da es kaum Hinweise auf eine Korrelation zwischen der Anzahl der Organismen und der Schwere der Erkrankung des Wirts gibt.
Anaplasmose ist eine weltweite Infektion, die in Nordamerika, dem größten Teil Europas und Ostasien auftritt. Zecken aus dem Ixodes persulcatus-Komplex sind die Überträger: I. scapularis im Nordosten und oberen Mittleren Westen der Vereinigten Staaten, I. pacificus im pazifischen Nordwesten, I. ricinus in Europa und I. persulcatus in Asien. A. phagocytophilum wird in der Natur durch den Wechsel zwischen diesen Zecken und verschiedenen kleinen Säugetieren, hauptsächlich Mäusen und anderen kleinen Nagetieren, erhalten. Da Ixodes-Zecken auch Überträger von Borreliose, Babesiose und Frühsommer-Meningoenzephalitis sind, kann eine Anaplasma-Koinfektion mit diesen anderen Krankheiten beim Menschen auftreten.
In den Vereinigten Staaten haben die Fälle von HGA die der humanen monozytären Ehrlichiose (HME) übertroffen. Ähnlich wie bei der HME und der humanen Ewingii-Ehrlichiose liegt das Durchschnittsalter der Patienten mit HGA bei etwa 50 Jahren.
Anzeichen und Symptome
Der klinische Verlauf von HGA reicht von einer asymptomatischen Infektion bis hin zu einer tödlichen Erkrankung. Die ersten Symptome, die etwa fünf bis zehn Tage nach dem Zeckenstich auftreten, sind weitgehend unspezifisch: Fieber, Schüttelfrost, starke Kopfschmerzen und Myalgien; Übelkeit, Husten und Arthralgien können ebenfalls auftreten. Ein Ausschlag ist selten, wurde aber berichtet.
Im Vergleich zu HME scheint es bei HGA weniger wahrscheinlich, dass das zentrale Nervensystem betroffen ist, aber periphere Neuropathien (z. B. Taubheit und Kribbeln) sind häufiger und können Wochen bis Monate andauern. Zu den neurologischen Befunden, über die in der medizinischen Fachliteratur berichtet wird, gehören Gesichtslähmung, demyelinisierende Polyneuropathie und Brachialplexopathie. Es wurde über ein Atemnotsyndrom und ein septisches oder toxisches schockähnliches Syndrom berichtet, das jedoch weniger häufig auftritt als bei HME. Die Gesamttodesrate bei HGA ist sehr niedrig (weniger als 1 %), wobei die meisten Todesfälle bei immungeschwächten Patienten auf opportunistische Infektionen zurückzuführen sind (z. B. Herpes-simplex-Ösophagitis, Candida-Pneumonitis und pulmonale Aspergillose).
Diagnose
Standard-Blutuntersuchungen bei HGA zeigen in der Regel ähnliche Befunde wie bei HME: Leukopenie, Thrombozytopenie und Leberfunktionsanomalien (erhöhte Transaminasen). Die hämatologischen Anomalien klingen jedoch häufig in der zweiten Woche nach Auftreten der Symptome ab, so dass ihr Fehlen in diesem Zusammenhang interpretiert werden sollte, wenn sich die Patienten erst später im Verlauf ihrer Krankheit vorstellen. Im Allgemeinen sollte bei Patienten in endemischen Gebieten, die sich mit einer akuten fieberhaften Erkrankung vorstellen, die auf eine HGA schließen lässt, eine empirische Antibiotikabehandlung in Erwägung gezogen werden.
Für eine spezifische Diagnose haben Wright- oder Giemsa-gefärbte Blutausstriche eine etwas höhere Ausbeute als HME, sind aber für den allgemeinen klinischen Nutzen immer noch nicht optimal, da es offenbar eine große Schwankungsbreite (25-75 %) in der Empfindlichkeit dieser Tests bei der Visualisierung von Morulae in Wirtsneutrophilen gibt. Hilfreicher, aber nicht immer verfügbar, sind Polymerase-Kettenreaktionstests (PCR), deren Empfindlichkeit auf 67-90 % geschätzt wird. Eine vorangegangene Antibiotikatherapie verringert die Empfindlichkeit beider Diagnosemethoden drastisch.
Serologische Tests sind nützlich, um die Diagnose der Anaplasmose zu bestätigen. Die am häufigsten verwendete Methode ist die indirekte Immunfluoreszenz (IFA) von IgM- und IgG-Anti-A. phagocytophilum-Antikörpern. Die Serokonversion ist vielleicht der empfindlichste Labornachweis für eine Infektion mit A. phagocytophilum, wird aber nicht immer rechtzeitig genug erhoben, um nützliche Informationen für klinische (d. h. Behandlungs-)Entscheidungen zu liefern.