Milchkrautwanze – Zelus longipes Linnaeus
Gebräuchlicher Name: Milchkrautwanze (vorgeschlagener gebräuchlicher Name)wissenschaftlicher Name: Zelus longipes Linnaeus (Insecta: Hemiptera: Reduviidae)
Zelus longipes Linnaeus wird gemeinhin als Milchkrautwanze bezeichnet, da sie der Milchkrautwanze, Oncopeltus fasciatus (Dallas), sehr ähnlich sieht. Sie ist auch als langbeinige Mordwanze und als Zelus-Mordwanze bekannt (Bug Guide). Die Mitglieder der Gattung Zelus gehören zur Unterfamilie der Harpactorinae und sind tagaktiv. Sie sind generalistische Raubtiere, die sich in Gärten und auf Feldern von einer Vielzahl von Weichkörpern ernähren, z. B. von Mücken, Fliegen, Regenwürmern, Gurkenkäfern und Raupen (Heerwurm, Wurzelwurm usw.).).
Abbildung 1. Ausgewachsene Milchkrautwanze, Zelus longipes Linnaeus, mit ihren langen Beinen und dem Schnabel (Stilett), auf einer Maisquaste sitzend. Foto von Megha Kalsi, University of Florida.
Verbreitung (Nach oben)
Zelus longipes ist weit verbreitet im südlichen Nordamerika (Golfküste und südliche Atlantikstaaten; Südkalifornien und südwestliches Arizona in den USA), in Mittelamerika, Südamerika (außer Chile) bis Zentralargentinien und den Westindischen Inseln (Hart 1986, Melo 2005, Wolf und Reid 2001, Cogni et al. 2000).
Beschreibung und Lebenszyklus (Zurück zum Anfang)
Diese Art weist eine große Variation in Größe und Farbe auf, was in der Vergangenheit zu Verwirrung bei der korrekten Artbestimmung führte. Die größte Farbvariation wird in den Populationen der Westindischen Inseln beobachtet, wo die Individuen orange-braun, bräunlich-schwarz und sogar ganz schwarz sein können (Hart 1986). Die Populationen in den Vereinigten Staaten sind deutlich orange und schwarz gefärbt. Adulte und Nymphen haben einen birnenförmigen Kopf, einen verengten Hals und lange, behaarte Beine. Ihre stechenden und saugenden Mundwerkzeuge haben einen dreiteiligen Schnabel, der im Ruhezustand gebogen ist und in einer Rille unter dem Thorax gehalten wird.
Erwachsene: Die Männchen sind kleiner als die Weibchen. In den Populationen in Kalifornien und Arizona waren die Männchen im Durchschnitt 16,1 mm und die Weibchen 18,4 mm lang, während die Männchen und Weibchen in den Populationen an der Golfküste im Durchschnitt 16,8 mm bzw. 18,2 mm lang waren. Bei den Weibchen ist das endständige Abdominalsegment plattenförmig oder abgeflacht, während es bei den Männchen schalenförmig oder abgerundet ist (Hart 1986). Es ist bekannt, dass adulte Tiere überwintern.
Adulte Zelus longipes können anhand der folgenden morphologischen Merkmale von anderen Zelus-Arten unterschieden werden:
Am Pronotum sind die Humeruswinkel unbewehrt und abgerundet,
Die Rückenfläche des Insekts ist bräunlich-rot bis bräunlich-schwarz gefärbt,
Die Parameren (oder Seitenlappen des männlichen Geschlechtsorgans) sind zylindrisch und lang und übertreffen 1/4 der Länge der Medianlappen.
Abbildung 2. Ausgewachsenes Weibchen von Zelus longipes Linnaeus, das auf einer Maisquaste sitzt. Foto von Megha Kalsi, University of Florida.
Abbildung 3. Ausgewachsene Milchsaugerwanzen, Zelus longipes Linnaeus, bei der Paarung in einem Zuckermaisfeld. Foto von Megha Kalsi, University of Florida.
Eier: Die Eier sind zylindrisch und länglich geformt, unverziert, braun gefärbt, mit einer hellbraunen, kappenartigen Struktur (Operculum genannt), die eine zentrale Pore mit einer trichterförmigen Öffnung aufweist. Das Ei kann in zwei Teile unterteilt werden: das Operculum (das am vorderen Pol des Eies befestigt ist) und die Haupteierschale oder das Chorion (Wolf und Reid 2000). Jedes Ei misst 2,0-2,3 mm in der Gesamtlänge, während das Anhängsel 0,5 mm lang ist (bekanntlich das längste unter allen Wanzen). Der Rest der Haupteierschale misst 1,5 mm in der Länge. Die Haupteierschale ist am hinteren Pol am breitesten (0,53 mm) und verengt sich in der Nähe des vorderen Pols (0,32 mm). Der vordere Pol ist flach und mit dem vorderen Anhängsel an einer deutlichen taillenförmigen Verbindung verbunden. Von der Seite betrachtet erscheint die Eierschale seitlich abgeflacht und leicht nach innen gekrümmt (Wolf und Reid 2000).
Abbildung 4. Die Eier der Milchtöterwanze, Zelus longipes Linnaeus, zeigen die zentrale Pore (a) im Operculum eines Eies und die schleimige Schicht (b), die die Haupteierschalen, nicht aber die Opercula umgibt. Foto von Megha Kalsi, University of Florida.
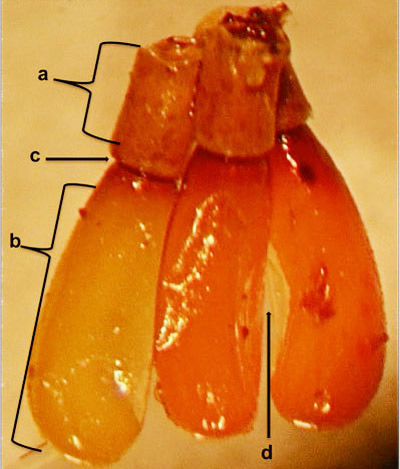
Abbildung 5. Seitliche Ansicht von Eiern der Milchkrautwanze, Zelus longipes Linnaeus, mit dem Operculum (a), der Haupteierschale (b), der hüftartigen Verbindung (c) und dem an einer Seite abgeflachten und leicht nach innen gebogenen Ei (d). Foto von Megha Kalsi, University of Florida.
Die Haupteierschale hat eine glatte Oberfläche. Das vordere Anhängsel zeigt bei der Betrachtung unter dem REM (Rasterelektronenmikroskop) im Inneren eine sehr abwechslungsreiche Architektur. Die zylindrische äußere Schicht des vorderen Anhängsels wird als Schleier bezeichnet, der durchgehend mit der Haupteierschale verbunden ist und einen ungefähr gleichen Durchmesser hat. Der Schleier faltet sich am vorderen Pol nach innen und bildet eine Doppelschicht, in der sich zahlreiche wabenartige Strukturen befinden. Die Funktion des Schleiers besteht darin, die Feuchtigkeit für den sich entwickelnden Embryo zu regulieren. Wenn man den Schleier teilweise entfernt, wird die topografische Anordnung der wichtigen Komponenten des vorderen Anhängsels sichtbar, nämlich die Mikropyle (an der Basis des Schleiers) und das Operculum. Die Mikropyle dienen dem Gasaustausch, während das Operculum eine plattenartige Struktur ist, die am vorderen Teil des Eies befestigt ist und beim Schlüpfen angehoben wird. Die Eier werden in einer Gruppe von 15 oder mehr Eiern abgelegt, die an der Basis zusammengeklebt und mit zähflüssigem Material bedeckt sind (mit Ausnahme des vorderen Anhängsels, das die Funktion hat, die Aeropylen vor Verstopfung zu schützen) (Wolf und Reid 2000).
Abbildung 6. Eine Eimasse der Milchkrautwanze, Zelus longipes Linnaeus, umgeben von einer schleimigen Schicht und abgelegt auf der Unterseite eines Maisblattes. Man beachte, dass die Eihäute nicht bedeckt sind. Foto von Megha Kalsi, University of Florida.
Abbildung 7. Ein erwachsenes Weibchen von Zelus longipes Linnaeus, das seine Eier in einem Käfig ablegt. Foto von Megha Kalsi, University of Florida.
Nymphen: Zelus longipes durchläuft fünf Nymphenstadien, bevor sie sich zu Erwachsenen entwickelt.
Erster Larvenstadium: Der Körper ist länglich mit einem differenzierten Hals, hellbraun gefärbt und misst 2,61 mm in der Länge. Der Kopf ist birnenförmig und misst 0,80 mm in der Länge und 0,50 mm in der Breite mit spärlichen Seten. Die auffälligen rötlich-braunen Augen sind 0,22 mm breit (Ozellen sind nicht vorhanden). Die Fühler sind fadenförmig, behaart und 3,98 mm lang. Die Beine sind dunkelbraun gefärbt, mit Ausnahme der Coxa, die hellbraun ist. Der Hinterleib ist dunkelbraun bis orange gefärbt und hat eine runde Form mit ein paar Haaren auf den letzten Segmenten. In diesem Stadium fehlen die Flügelbinden (Melo et al. 2005).
Abbildung 8. Aus den Eiern schlüpfende Nymphen des Milchkrautmörders Zelus longipes Linnaeus, die langsam ihre Beine ausstrecken. Foto von Megha Kalsi, University of Florida.
Abbildung 9. Nymphe im ersten Larvenstadium von Zelus longipes Linnaeus, mit Dorsalansicht (links und Mitte) und Ventralansicht (rechts). Foto von Megha Kalsi, Universität von Florida.
Abbildung 10. Eine Ansammlung von Nymphen des ersten Larvenstadiums von Zelus longipes Linnaeus, die aus den auf einem Maisblatt abgelegten Eiern schlüpfen. Foto von Megha Kalsi, University of Florida.
Abbildung 11. Nymphe des Milchkrautmörders Zelus longipes Linnaeus im ersten Larvenstadium, die sich von einer Nymphe der winzigen Raubwanze Orius insidiosus (Say) ernährt. Foto von Megha Kalsi, University of Florida.
Zweiter Instadium: Der Körper ist jetzt länglicher und misst 4,26 mm in der Länge mit blassbrauner Farbe und orangefarbenem Schimmer (Melo et al. 2005). Der Kopf ist ebenfalls länglicher, 1,08 mm lang und 0,67 mm breit, im Vergleich zum vorherigen Instadium. Die Beine sind schwarz mit leicht gefärbten Coxa. Der Hinterleib ist gerundet und mit schwach sichtbaren Schweißdrüsen besetzt. Die Flügelbinden sind nun vorhanden, sie sind dunkelbraun bis schwarz gefärbt und 0,35 mm lang.
Abbildung 12. Vorderansicht einer Nymphe im zweiten Larvenstadium (a) und der Leibeshöhle (b) der Milchsammlerwanze, Zelus longipes Linnaeus. Foto von Megha Kalsi, University of Florida.
Dritter Larvenstadium: Der Körper ist langgestreckt und 5,73 mm lang ( Melo et al. 2005). Der Kopf ist 1,56 mm lang und 0,78 mm breit. Er ist einheitlich orangefarben und mit Seten besetzt. Die Fühler sind 7,5 mm lang und haben eine ähnliche Farbe und Bänderung wie die des vorherigen Stadiums. Die Beine und die Farbe der Flügeldecken sind die gleichen wie im vorigen Instadium. Die Länge der Flügelbinde beträgt jetzt durchschnittlich 0,84 mm. Der Hinterleib ist gerundet, mit Seten und sichtbaren Duftdrüsenöffnungen.
Abbildung 13. Dorsalansicht einer Nymphe im dritten Larvenstadium und Exuvie (Insert) der Milchtöterwanze, Zelus longipes Linnaeus. Foto von Megha Kalsi, University of Florida.
Abbildung 14. Seitliche Ansicht einer Nymphe des dritten Larvenstadiums von Zelus longipes (Linnaeus), der Wanze des Milchkrautmörders. Der Kopf liegt rechts, und der Stilett (in Ruhestellung nach hinten zeigend) ist unter dem Kopf sichtbar. Foto von Megha Kalsi, University of Florida.
Vierter Instadium: Die Gesamtkörperlänge beträgt 7,14 mm (Melo et al. 2005). Die Kopfbreite und -länge beträgt 0,97 mm bzw. 2,05 mm. Die Antennenlänge beträgt jetzt 10,23 mm, die Antennen sind schwarz und haben zwei distale blasse Bänder (hellbraun) auf dem ersten Segment. Das zweite und dritte Fühlersegment sind abgesetzt. Die Beine sind schwarz mit drei hellen Bändern, eines auf dem Vorderschenkel und zwei auf dem mittleren und hinteren Oberschenkel. Die Flügeldecken sind schwarz, behaart und 1,37 mm lang. Der Hinterleib ist im Vergleich zu den vorherigen Stadien länglicher und behaarter und misst 2,67 mm in der Länge und 0,65 mm in der Breite. Der hintere Teil ist gelb gefärbt mit auffälligen schwarzen Dorsalflecken auf den Sterniten VI und VII.
Fünfter Instar: Der orangefarbene Körper ist langgestreckt und misst 11,29 mm (Melo et al. 2005). Die Kopflänge und -breite beträgt 2,77 mm bzw. 1,26 mm. Die Augen sind auffallend schwarz. Die Antennen sind 14,56 mm lang und ähneln in Bezug auf Farbe, Bindenmuster und Seten den vorherigen Instars. Das zweite Segment der Antenne hat fünf Trichobothrien (längliche, nicht spitz zulaufende Fühler), während die übrigen drei Segmente reichlich Fühler haben. Die Flügeldecken sind 3,54 mm lang, gefiedert und schwarz. Der Hinterleib ist orangefarben, satiniert, 4,97 mm lang und 1,77 mm breit. Die Seitenränder des Hinterleibs weisen dünne weißlich-gelbe Streifen auf.
Wirtschaftliche Bedeutung (Zurück zum Anfang)
Zelus longipes ist zwar ein generalistischer Räuber, aber auch ein wichtiger Räuber wichtiger wirtschaftlicher Schädlinge wie des Heerwurms Spodoptera frugiperda (Cogni et al. 2000), der Asiatischen Zitruspyllide Diaphorina citri (Hall 2008) und der Ginster-Ginster-Motte Uresiphita reversalis Guenée (Carrel 2001).
Ein Biss von Zelus longipes ist zwar für den Menschen nicht gefährlich, kann aber bei unsachgemäßer Behandlung ein brennendes Gefühl mit Schwellung verursachen, das mehrere Tage anhalten kann.
Fressverhalten (Zurück zum Anfang)
Die Strategie, die Zelus longipes anwendet, um ihre Beute zu fangen, ist als „Klebefallenstrategie“ bekannt. Wie viele Wanzen aus dem Hinterhalt greift Zelus longipes ihre Beute an, nachdem sie sich im Laub versteckt und ihre Vorderbeine in die Luft gestreckt hat. Die Vorderbeine von Zelus longipes sind mit einem zähflüssigen Material überzogen, das wie ein Klebstoff wirkt und die Beute einfängt. Zelus longipes lähmt dann schnell seine Beute, indem sie ihre Stile in den Wirtskörper einführt, und bereitet sich durch extraorale Verdauung auf die Nahrungsaufnahme vor. Die extraorale Verdauung ist eine Verdauungsmethode, bei der ein Raubtier Enzyme in seine Beute freisetzt, um das Gewebe des Wirts aufzulösen, und später die gelöste Flüssigkeit mit seinem Stilett als Strohhalm aufsaugt (Wolf und Reid 2001). Zelus longipes kann sich von Beutetieren ernähren, die bis zu sechsmal so groß sind wie sie selbst. Mit zunehmender Größe der Beute steigt jedoch auch die Handhabungs- und Fütterungszeit für Zelus longipes, wodurch sie anfällig für andere Raubtiere werden (Cogni et al. 2000).
Abbildung 15. Ausgewachsene Milchsaugerwanzen, Zelus longipes Linnaeus, die sich verstecken oder auflauern. Foto von Megha Kalsi, University of Florida.
Abbildung 16. Ausgewachsene Milchkrautwanze, Zelus longipes Linnaeus, auf der Lauer liegend (im Schatten oben links) mit erhobenen Vorderbeinen, kurz bevor sie ihre Beute, eine Kornseidenfliege, Euxesta stigmatias Loew, angreift (unten rechts). Foto von Megha Kalsi, University of Florida.
Abbildung 17. Ausgewachsenes Weibchen der Milchkrautwanze, Zelus longipes Linnaeus, lähmt seine Beute, eine Kornseidenfliege, Euxesta stigmatias Loew, durch Einstecken von Griffeln. Foto von Megha Kalsi, University of Florida.
Abbildung 18. Ausgewachsenes Weibchen von Zelus longipes Linnaeus, das sich von einer Kornseidenfliege, Euxesta stigmatias Loew, ernährt. Foto von Megha Kalsi, University of Florida.
Abbildung 19. Nymphe der Milchtöterwanze, Zelus longipes Linnaeus, die sich von Euxesta annonae Fabricius, einer Bilderfliege, ernährt. Foto von Megha Kalsi, University of Florida.
Ausgewählte Referenzen (Back to Top)
- BugGuide. (Oktober 2009). Species Zelus longipes – Milkweed Assassin Bug. BugGuide.net. http://bugguide.net/node/view/4832 (21. August 2018).
- Carrel JE. 2001. Response of predaceous arthropods to chemically defended larvae of the pyralid moth Uresiphita reversalis (Guenée) (Lepidoptera: Pyralidae). Journal of the Kansas Entomological Society 74: 128-135.
- Cogni R, Freitas AVL, Filho FA. 2000. Einfluss der Beutegröße auf den Prädationserfolg von Zelus longipes L. (Het., Reduviidae). Journal of Applied Entomology 126: 74-78.
- Hall DG. (2008). Biological control of Diaphorina citri. Concitver. http://www.concitver.com/huanglongbingYPsilidoAsiatico/Memor%C3%ADa-8%20Hall.pdf (21. August 2018).
- Hart ER. 1986. Genus Zelus Fabricius in the United States, Canada, and Northern Mexico (Hemiptera: Reduviidae). Annals of the Entomological Society of America 79: 535-548.
- Melo MC, Coscaron MC, Filho BA. 2005. Immature stages of Zelus longipes (Heteroptera: Reduviidae, Harpactorinae). Transactions of the American Entomological Society 31: 101-110.
- Ralston JS. 1977. Egg guarding by male assassin bug of the genus Zelus (Hemiptera: Reduviidae). Psyche 84: 103-107.
- Wolf KW, Reid W. 2000. The architecture of the anterior appendage in the egg of the assassin bug, Zelus longipes (Hemiptera: Reduviidae). Arthropod Structure and Development 29: 333-341.
- Wolf KW, Reid W. 2001. Surface morphology of legs in the assassin bug Zelus longipes (Hemiptera: Reduviidae): Eine rasterelektronenmikroskopische Untersuchung mit Schwerpunkt auf Haaren und Poren. Annals of the Entomological Society of America 94: 457-461.