Naturwissenschaftliche Projekte für Anfänger: Chemie
Chemie
Salz oder Zucker: Was sich schneller in verschiedenen Flüssigkeiten auflöst
Lösungen sind nichts anderes als Mischungen aus verschiedenen Verbindungen oder Elementen. Sie kommen jeden Tag mit Lösungen in Berührung, ohne dass Sie sich dessen bewusst sind.
Auch die Luft, die Sie atmen, enthält Wasser und ist eine Lösung aus einer Flüssigkeit und einem Gas. Wenn Sie heute eine Limonade getrunken haben, haben Sie eine Lösung aus einem Gas getrunken, das in aromatisiertem Wasser gelöst ist. Wenn du ein Armband aus Sterlingsilber trägst, trägst du eine Lösung aus zwei Metallen.
In diesem Experiment wirst du mit einer flüssigen Lösung arbeiten, die eine von drei Arten von Lösungen ist. Die anderen sind gasförmige Lösungen und feste Lösungen.
Was ist also das Problem?
Ein gelöster Stoff ist die Substanz – entweder ein Feststoff, eine Flüssigkeit oder ein Gas – die gelöst wird. Ein Lösungsmittel – ebenfalls ein Feststoff, eine Flüssigkeit oder ein Gas – ist die Substanz, die sich auflöst. Eine Lösung ist ein gleichmäßiges Gemisch aus einem gelösten Stoff (in der Regel ein Feststoff), der in einem Lösungsmittel (in der Regel eine Flüssigkeit) gelöst ist.
Wenn man einen Löffel Zucker in ein Glas Wasser rührt, bildet man eine Lösung. Diese Art von flüssiger Lösung besteht aus einem festen Stoff, dem Zucker, und einem flüssigen Lösungsmittel, dem Wasser. Da sich die Zuckermoleküle gleichmäßig im Wasser verteilen, löst sich der Zucker auf.
Wenn man eine Flüssigkeit mit einem Gas mischt, entsteht eine andere Art von Lösung, die als gasförmige Lösung bezeichnet wird. Ein Beispiel für diese Art von Lösung ist die Luftfeuchtigkeit. Feuchtigkeit ist Wasser (eine Flüssigkeit), das in Luft (einem Gas) gelöst ist.
Überlegen Sie, wie sich ein Würfelzucker in Wasser auflöst, verglichen mit einer Packung losem Zucker. Der Würfel löst sich langsamer auf, weil anfangs weniger Zuckermoleküle mit dem Wasser in Berührung kommen.
In einer festen Lösung, wie z. B. Sterlingsilber, wird hoch erhitztes Kupfer mit ebenfalls erhitztem Silber vermischt, bis es schmilzt. Das Kupfer ist der gelöste Stoff, d. h. die Substanz, die sich im Lösungsmittel auflöst. Das Silber ist das Lösungsmittel.
Die Art der Lösung wird durch den Aggregatzustand des Lösungsmittels bestimmt. Handelt es sich bei dem auflösenden Stoff um eine Flüssigkeit, wird die Lösung als flüssige Lösung bezeichnet. Handelt es sich bei dem Lösungsmittel um ein Gas, wird die Lösung als gasförmige Lösung bezeichnet. Und Sie haben richtig geraten: Ein festes Lösungsmittel bildet eine feste Lösung.
Die Größe der Salz- und Zuckerkristalle kannst du unter einem Mikroskop oder einer Lupe überprüfen, wobei du auch ihre Form erkennen kannst. Wenn du das, was du siehst, mit einem Bleistift zeichnest, um die Schattierungen zu veranschaulichen, könntest du die Illustration als Teil deiner Abschlusspräsentation deines Wissenschaftsprojekts einfügen.
Es gibt einige Faktoren, die im Allgemeinen die Menge des gelösten Stoffes erhöhen, die aufgelöst werden kann. Wenn du zum Beispiel mehr Zucker in der gleichen Menge Wasser auflösen willst, kannst du das Wasser erhitzen. Man kann den Zucker auch in kleinere Partikel zermahlen, um seine Oberfläche zu vergrößern, oder man kann die Mischung umrühren.
In den Jahren, in denen Sie Salz und Zucker für Ihre Speisen verwendet haben, ist Ihnen wahrscheinlich aufgefallen, dass jedes Stück Salz?das eigentlich ein Kristall ist, etwas kleiner ist als jedes Stück Zucker, das ebenfalls ein Kristall ist.
Ein Molekül besteht aus zwei oder mehr Elementen, die chemisch miteinander verbunden sind. Ein Salzmolekül enthält Natrium und Chlor, die chemisch miteinander verbunden sind und Natriumchlorid bilden. Die chemische Formel für dieses Salz lautet NaCl. Ein Zuckermolekül enthält Kohlenstoff, Wasserstoff und Sauerstoff. Die chemische Formel für Zucker lautet C12H22O11.
Das Problem, das du in diesem Experiment zu lösen versuchst, ist die Frage, ob sich Zucker oder Salz schneller auflöst, wenn man es in verschiedene Flüssigkeiten mischt. Hat die Größe der Stücke einen Einfluss darauf, wie schnell sie sich mit der Flüssigkeit vermischen?
Wenn man Zucker oder Salz in einer Flüssigkeit auflöst, z. B. in Wasser, bewegen sich die Zuckermoleküle, um sich zwischen die Wassermoleküle in einem Glas oder Becherglas einzufügen. Die folgende Abbildung zeigt, wie die verschiedenen Moleküle in dem Behälter angeordnet sind.
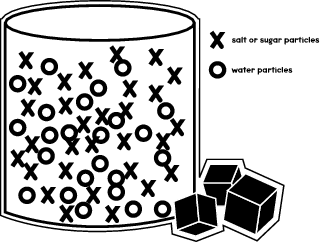
In deinem Experiment wirst du sehen, wie sich Salz- und Zuckermoleküle in verschiedenen Flüssigkeiten bewegen und sich unterschiedlich schnell auflösen.
Der Titel dieses Abschnitts, Salz oder Zucker: Which Dissolves Faster in Different Liquids?“ könnte als Titel für Ihr Projekt dienen, wenn Sie möchten. Sie könnten auch einen der folgenden Titel für Ihr Projekt in Erwägung ziehen:
- Der große Salz-gegen-Zucker-Auflösungswettbewerb
- Mit Salz und Zucker erforschen, wie sich Stoffe auflösen
Welchen Namen Sie auch wählen, er ist in Ordnung. Nehmt euch jetzt eine Minute Zeit, um zu überlegen, warum dieses Projekt eure Zeit wert ist.
Worum geht es?
Wenn zwischen den Molekülen eines Lösungsmittels viel Platz ist, spricht man von einem ungesättigten Lösungsmittel. Wenn eine große Menge des gelösten Stoffes in dem Lösungsmittel gelöst wurde, aber noch etwas Platz zwischen den Molekülen ist, ist die Lösung konzentriert. Wenn absolut kein gelöster Stoff mehr in einem Lösungsmittel gelöst werden kann, ist die Lösung gesättigt.
Und wenn der überschüssige gelöste Stoff durch Erhitzen der Lösung gelöst wurde, spricht man von einer übersättigten Lösung.
In diesem Experiment geht es nicht nur darum, zu erfahren, ob sich Salz oder Zucker in verschiedenen Flüssigkeiten schneller auflöst, sondern auch darum, zu lernen, wie Moleküle in einer Lösung zusammenwirken.
Wie du in der vorangegangenen Abbildung gesehen hast, nehmen die Wassermoleküle den größten Teil des Raums im Behälter ein. Aber es gibt immer noch etwas Platz, in den die Zucker- oder Salzmoleküle passen. Durch dein Experiment erfährst du, wie schnell die Zuckermoleküle im Vergleich zu den Salzteilchen in diese Räume passen.
Dieses Wissen wird dir helfen, den Prozess besser zu verstehen, der stattfindet, wenn sich eine Substanz auflöst.
Die Kontrolle in deinem Experiment wird Wasser sein. Die anderen Flüssigkeiten, in denen du Salz und Zucker auflöst, sind die Variablen.
| Kontrollen: | Lösungsmittel?Wasser |
| Lösungen?Zucker, Salz | |
| Variablen: | Fünf verschiedene klare Flüssigkeiten (können gefärbt sein) |
Denke bei der Durchführung deines Experiments daran, dass es sehr wichtig ist, dass die von dir verwendeten Flüssigkeiten alle die gleiche Temperatur haben. Du hast bereits gelernt, dass sich Zucker in einer warmen Flüssigkeit schneller auflöst als in einer kalten. Du weißt also, dass es kein genaues Experiment wäre, wenn einige der verwendeten Flüssigkeiten warm und einige kalt wären. Die Temperatur der Flüssigkeit würde zu einer Variable werden.
Daher sollten alle Flüssigkeiten, die du verwendest – einschließlich Wasser -, Zimmertemperatur haben. Wenn du sie normalerweise im Kühlschrank aufbewahrst, solltest du sie über Nacht stehen lassen, bis sie alle die gleiche Temperatur haben.
Um dir bei der Durchführung des Experiments etwas mehr Flexibilität zu verschaffen, kannst du die Flüssigkeiten, in denen du Zucker und Salz auflöst, selbst wählen. Es macht keinen Sinn, zusätzliche Flüssigkeiten zu kaufen, wenn du bereits hast, was du brauchst.
Nimm nicht an, dass Flüssigkeiten, die in verschiedenen Bereichen deines Hauses gestanden haben, die gleiche Temperatur haben. Eine Flasche Soda, die in der Garage gestanden hat, kann um einige Grad kühler sein als Franzbranntwein aus dem Badezimmerschrank oder Apfelsaft aus der Küchenvorratskammer. Achten Sie darauf, dass sich alle Flüssigkeiten am selben Ort befinden, damit sie die gleiche Raumtemperatur erreichen. If you don’t, the results of your experiment won’t be valid.
Just make sure you choose liquids that are different from each other in taste, color, odor, and purpose. You’ll also need to select those that allow you to observe the salt and sugar as it dissolves. If you use milk or orange juice, for example, you won’t be able to watch the salt and sugar dissolve. Some suggestions for liquids to consider are:
- White vinegar
- Club soda
- Ginger ale
- Glass cleaner (such as Windex)
- Lemonade
- Tea or iced tea (each at room temperature)
- Apple juice
- Rubbing alcohol
All of these are commonly found around the house, perhaps saving you a trip to the store.
What Do You Think Will Happen?
Nachdem du nun weißt, wie Lösungen entstehen und welche Faktoren die Geschwindigkeit beeinflussen, mit der sich Zucker und Salz auflösen, solltest du in der Lage sein, eine gute Vermutung darüber anzustellen, welche Lösung sich schneller auflöst.
Wenn du dieses Experiment noch nicht gemacht hast, wirst du nicht wissen, ob die Flüssigkeiten, die du verwendest, einen Einfluss auf das Auflösen von Salz und Zucker haben. Das macht es schwieriger, eine Hypothese aufzustellen, aber mach dir keine Sorgen. Ob deine Hypothese richtig ist oder nicht, hat keinen Einfluss auf die Gültigkeit oder das Ergebnis deines Experiments.
Du wirst zwar erst nach deinem Experiment wissen, ob die Eigenschaften der verschiedenen Flüssigkeiten, die du ausgewählt hast, die Auflösungsgeschwindigkeit von Salz und Zucker beeinflussen, aber du weißt, dass Salzkristalle im Allgemeinen kleiner sind als Zuckerkristalle. Und du weißt, dass die Temperatur der Flüssigkeiten in deinem Experiment keine Rolle spielen wird.
Versuch einfach, deine bisherigen Erfahrungen, die Informationen, die du in diesem Abschnitt gelesen hast, und deinen gesunden Menschenverstand zu nutzen, um eine vernünftige Hypothese aufzustellen.
Gedenk daran, dass deine Hypothese als objektiver Satz formuliert werden muss, nicht als Frage. Stellen Sie also Ihre Vermutung auf, ob sich das Salz oder der Zucker schneller auflöst, und beginnen wir mit dem Experiment.
Materialien, die Sie für dieses Projekt benötigen
Einige der für dieses Experiment vorgeschlagenen Flüssigkeiten sind weißer Essig, Club Soda, Ginger Ale, Glasreiniger, Reinigungsalkohol, Apfelsaft, Limonade und Tee. Wenn Sie eine oder mehrere der vorgeschlagenen Flüssigkeiten durch eine andere ersetzen möchten, ist das kein Problem. Achte nur darauf, dass alle Flüssigkeiten klar sind und Zimmertemperatur haben.
Die unten aufgeführten Mengen an Materialien reichen aus, um das Experiment dreimal mit jeder Flüssigkeit durchzuführen. You’ll need:
- 12 clear, plastic cups (10 ounce )
- One permanent marker
- One (1 teaspoon) (5.0 ml) measuring spoon
- One (12 teaspoon) (2.5 ml) measuring spoon
- One (1 cup) (240 ml) measuring cup
- 8 teaspoons (40 ml) salt, divided in 16 (12 teaspoon) portions
- 8 teaspoons (40 ml) sugar, divided in 16 (12 teaspoon) portions
- 48 ounces (1,440 ml) water at room temperature
- 24 ounces (720 ml) each of five different, clear liquids, all at room temperature
- One clock or watch with a second hand
- One clear plastic cup containing eight fluid ounces (240 ml) water at room temperature
Remember to make sure that all liquids are at room temperature.
Conducting Your Experiment
When you’ve gathered all your materials, you’ll be ready to begin your experiment. Befolge einfach diese Schritte:
Behalte einen Becher mit klarem Wasser in Sichtweite, damit du ihn mit den Bechern mit Salz und Zucker vergleichen kannst. Es wird interessant sein zu beobachten, wie sich das Aussehen der Flüssigkeiten verändert, wenn sich Salz und Zucker auflösen.
Es wird eine Weile dauern, bis sich Zucker und Salz aufgelöst haben. Um optimale Ergebnisse zu erzielen, sollten Sie die Lösungen nicht umrühren, da dies eine zusätzliche Variable darstellt. Wenn du rühren musst, dann rühre jede Lösung dreimal um und höre dann auf. Rühren Sie erst um, wenn Sie feststellen, dass sich die Lösung am Boden der beiden Behälter befindet. Wenn du die Lösungen ungleichmäßig umrührst, ist dein Experiment ungültig.
- Schreibe mit dem Permanentmarker „Salz“ auf sechs der Plastikbecher und „Zucker“ auf die anderen sechs.
- Gib 1/2 Teelöffel (2,5 ml) Salz in jeden der sechs Becher mit der Aufschrift „Salz“.
- Gib 1/2 Teelöffel (2,5 ml) Zucker in jeden der sechs Becher mit der Aufschrift „Zucker“.
- Gib 240 ml Wasser in eine Tasse mit Salz und in eine Tasse mit Zucker. Notiere sofort die Zeit, zu der das Wasser hinzugefügt wurde, in einer Datentabelle, die der im nächsten Abschnitt „Behalte den Überblick über dein Experiment“ ähnelt.
- Beobachte, wie sich die gelösten Stoffe (Salz und Zucker) in dem Lösungsmittel (Wasser) auflösen. Notiere in der Tabelle die Zeit, zu der sich jeder gelöste Stoff deiner Meinung nach vollständig aufgelöst hat. Diese Zeiten werden wahrscheinlich nicht identisch sein.
- Berechne die verstrichene Zeit, in der sich der Stoff aufgelöst hat. Nimm die Zeit, zu der das Wasser in die Becher gegeben wurde und die Auflösung begann, und ziehe sie von der Zeit ab, zu der die Auflösung endete. So erhältst du die Gesamtminuten, die das Salz und der Zucker brauchten, um sich vollständig in der Flüssigkeit aufzulösen.
- Wiederhole die Schritte 4 bis 6, wobei du jeweils eine andere Flüssigkeit anstelle des Wassers verwendest.
- Wasche, spüle und trockne jede der 12 Tassen gründlich ab.
- Wiederhole die Schritte 2 bis 8 zwei weitere Male, so dass du insgesamt drei Versuche für jede der sechs Flüssigkeiten hast.
- Berechne die durchschnittliche Auflösungszeit für das Salz und den Zucker in jeder der sechs Flüssigkeiten.
Erinnere dich daran, dass du zur Ermittlung der durchschnittlichen Zeit, die das Salz und der Zucker in jeder Flüssigkeit benötigt haben, die drei für jede Flüssigkeit aufgezeichneten Zeiten addierst und dann durch drei teilst. Die Zahl, die du erhältst, wenn du die Zeiten teilst, ist die Durchschnittszeit.
Keeping Tracking Your Experiment
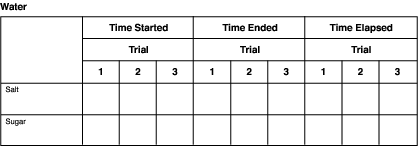
Diagramme wie das folgende können verwendet werden, um Informationen für jedes Lösungsmittel aufzuzeichnen. Ändern Sie einfach die Namen der Lösungsmittel in der Überschrift.
Sichern Sie sich, dass Sie die Zeiten aufschreiben, während Sie weiterarbeiten. Verlassen Sie sich nicht auf Ihr Gedächtnis, um sie später aufzuschreiben. Du wirst eine Menge Zahlen haben, wenn du dein Experiment beendest.
Zusammenfassung
Was hast du über die Auflösungsgeschwindigkeit von Salz und Zucker herausgefunden? Haben Sie bewiesen, dass Ihre Hypothese richtig ist? Oder falsch? Konnten Sie bei der Zugabe des Salzes und des Zuckers zu den verschiedenen Flüssigkeiten ein bestimmtes Muster erkennen? War es offensichtlich, dass sich das Salz in einigen Flüssigkeiten besser und schneller auflöste als der Zucker? Fallen dir Gründe dafür ein?
Denkst du, dass die chemische Beschaffenheit des gelösten Stoffes und des Lösungsmittels die Auflösungsgeschwindigkeit beeinflusst hat? Nutzen Sie die Informationen, die Sie bei der Recherche zu Ihrem Thema gesammelt haben, um diese Fragen zu beantworten.
Je mehr Sie über Ihr Projekt wissen, desto besser werden Sie in der Lage sein, Ihre Daten richtig zu analysieren und zu einer fundierten Schlussfolgerung zu gelangen.
Weitere Untersuchungen
Wie bereits erwähnt, sind die Faktoren, die die Löslichkeit von festen Stoffen beeinflussen, folgende:
- Erhöhung oder Verringerung der Temperatur des Lösungsmittels
- Vergrößerung der Oberfläche des gelösten Stoffes
- Rühren
Wenn du dieses Projekt ein oder zwei Schritte weiterführen möchtest, könntest du ein Experiment entwerfen, das eine?
Sie könnten die Auflösungsgeschwindigkeit von Würfelzucker in einer Flüssigkeit mit der Auflösungsgeschwindigkeit von Kristallzucker vergleichen.
Oder Sie könnten die gleiche Lösung, z. B. Zucker, verwenden und testen, ob sie sich durch Rühren schneller auflöst. Auch das Erhitzen und Abkühlen des Lösungsmittels bei Zugabe desselben Stoffes wäre eine Möglichkeit für weitere Experimente.
Wenn du neugierig und experimentierfreudig bist, fallen dir wahrscheinlich viele Varianten für dieses Projekt ein. Und da für das Experiment nur gängige, preiswerte Materialien benötigt werden, solltest du nach Herzenslust experimentieren können.
Auszug aus The Complete Idiot’s Guide to Science Fair Projects 2003 von Nancy K. O’Leary und Susan Shelly. Alle Rechte vorbehalten, einschließlich des Rechts auf Vervielfältigung im Ganzen oder in Teilen in jeder Form. Verwendet nach Absprache mit Alpha Books, einem Mitglied der Penguin Group (USA) Inc.
Um dieses Buch direkt beim Verlag zu bestellen, besuchen Sie die Website von Penguin USA oder rufen Sie 1-800-253-6476 an. Sie können dieses Buch auch bei Amazon.com und Barnes & Noble erwerben.