Sauerstofffamilie
Die Sauerstofffamilie besteht aus den Elementen, die die Gruppe 16 des Periodensystems bilden: Sauerstoff, Schwefel, Selen, Tellur und Polonium. Diese Elemente haben alle sechs Elektronen in ihrem äußersten Energieniveau, was ihnen einige gemeinsame chemische Eigenschaften verleiht. In anderer Hinsicht sind die Elemente recht unterschiedlich. Sauerstoff ist ein gasförmiges Nichtmetall; Schwefel und Selen sind feste Nichtmetalle; Tellur ist ein festes Metalloid; und Polonium ist ein festes Metall.
Wörter zum Kennenlernen
Säuren: Stoffe, die in Wasser gelöst mit einer Base unter Bildung von Salzen und Freisetzung von Wasserstoff-Ionen reagieren können.
Allotrop: Eine von zwei oder mehr Formen eines Elements.
Verbrennung: Eine Form der Oxidation, die so schnell abläuft, dass spürbare Wärme und Licht erzeugt werden.
Cracken: Der Prozess, bei dem große Kohlenwasserstoffmoleküle in kleinere Bestandteile aufgespalten werden.
Elektrolyse: Der Prozess, bei dem ein elektrischer Strom eine chemische Veränderung bewirkt, in der Regel den Abbau einer Substanz.
Isotope: Zwei oder mehr Formen desselben Elements mit der gleichen Anzahl von Protonen, aber unterschiedlicher Anzahl von Neutronen im Atomkern.
Lithosphäre: Der feste Teil der Erde, insbesondere der äußere Krustenbereich.
LOX: Eine Abkürzung für flüssigen Sauerstoff.
Metallurgie: Die Wissenschaft und Technologie, die sich mit der Gewinnung von Metallen aus ihren Erzen und deren Umwandlung in Formen von praktischem Wert beschäftigt.
Naszierender Sauerstoff: Ein Allotrop des Sauerstoffs, dessen Moleküle jeweils ein einzelnes Sauerstoffatom enthalten.
Ozon: Ein Allotrop des Sauerstoffs, das aus drei Atomen pro Molekül besteht.
Erzeugergas: Ein synthetischer Brennstoff, der hauptsächlich aus Kohlenmonoxid und Wasserstoffgasen besteht.
Proteine: Große Moleküle, die für die Struktur und das Funktionieren aller lebenden Zellen wichtig sind.
Radioaktiver Zerfall: Die vorhersehbare Art und Weise, in der eine Population von Atomen eines radioaktiven Elements mit der Zeit spontan zerfällt.
Sauerstoff
Sauerstoff ist ein farbloses, geruchloses, geschmackloses Gas mit einem Schmelzpunkt von -218 °C und einem Siedepunkt von -183 °C. Es ist das am häufigsten vorkommende Element in der Erdkruste und macht etwa ein Viertel des Gewichts der Atmosphäre, etwa die Hälfte der Lithosphäre (Erdkruste) und etwa 85 Prozent der Hydrosphäre (Ozeane, Seen und andere Formen von Wasser) aus. Es kommt sowohl als freies Element als auch in einer großen Vielfalt von Verbindungen vor. In der Atmosphäre kommt er als elementarer Sauerstoff vor, der manchmal auch als Dioxygen bezeichnet wird, weil er aus zweiatomigen Molekülen, O 2 , besteht. Im Wasser kommt er als Wasserstoffoxid, H 2 O, vor, und in der Lithosphäre kommt er in Verbindungen wie Oxiden, Karbonaten, Sulfaten, Silikaten, Phosphaten und Nitraten vor.
Sauerstoff kommt auch in zwei allotropen Formen vor (physikalisch oder chemisch unterschiedliche Formen desselben Stoffes): ein Atom pro Molekül (O) und drei Atome pro Molekül (O 3 ). Das erste Allotrop wird als monatomarer oder naszierender Sauerstoff und das zweite als triatomischer Sauerstoff oder Ozon bezeichnet. Unter den meisten Umständen in der Natur überwiegt die zweiatomige Form des Sauerstoffs. Im oberen Teil der Stratosphäre bewirkt die Sonnenenergie jedoch den Zerfall der zweiatomigen Form in die einatomige Form, die sich dann wieder mit zweiatomigen Molekülen zu Ozon verbinden kann. Das Vorhandensein von Ozon in der Erdatmosphäre ist für das Überleben des Lebens auf der Erde von entscheidender Bedeutung, da dieses Allotrop dazu neigt, ultraviolette Strahlung zu absorbieren, die andernfalls für das pflanzliche und tierische Leben auf der Erdoberfläche schädlich oder sogar tödlich wäre.
Sauerstoff wurde unabhängig voneinander von dem schwedischen Chemiker Carl Scheele (1742-1786) und dem englischen Chemiker Joseph Priestley (1733-1804) in den Jahren 1773 bis 1774 entdeckt. Seinen Namen erhielt das Element in den späten 1770er Jahren von dem französischen Chemiker Antoine Laurent Lavoisier (1743-1794). Der Name leitet sich vom französischen Wort für „Säurebildner“ ab und spiegelt Lavoisiers falsche Annahme wider, dass alle Säuren Sauerstoff enthalten.
Herstellung. Die bei weitem häufigste Methode zur kommerziellen Herstellung von Sauerstoff ist die fraktionierte Destillation von flüssiger Luft. Eine Luftprobe wird zunächst auf eine sehr niedrige Temperatur im Bereich von -200°C (-330°F) abgekühlt. Bei dieser Temperatur werden die meisten Gase, aus denen Luft besteht, flüssig. Anschließend lässt man die flüssige Luft verdampfen. Bei einer Temperatur von etwa -196 °C (-320 °F) beginnt der Stickstoff zu verdampfen. Wenn der größte Teil des Stickstoffs verschwunden ist, verdampfen auch Argon und Neon, wobei eine unreine Form von Sauerstoff zurückbleibt. Der Sauerstoff ist unrein, weil kleine Mengen von Krypton, Xenon und anderen Gasen in der flüssigen Form zurückbleiben können. Um den Sauerstoff weiter zu reinigen, kann der Prozess der Abkühlung, Verflüssigung und Verdampfung wiederholt werden.
Sauerstoff wird üblicherweise in flüssiger Form gelagert und transportiert, eine Form, die auch als LOX (für l iquid ox ygen) bekannt ist. LOX-Behälter sehen aus wie sehr große Vakuumflaschen, die aus einem doppelwandigen Behälter mit einem Vakuum zwischen den Wänden bestehen. Das Element kann auch in gasförmiger Form in stahlwandigen Behältern mit einer Höhe von etwa 1,2 Metern und einem Durchmesser von 23 Zentimetern gelagert und transportiert werden, was weniger einfach ist. In vielen Fällen wird Sauerstoff an dem Ort hergestellt, an dem er verwendet werden soll. Das oben beschriebene Verfahren der fraktionierten Destillation ist so einfach und kostengünstig, dass viele Industrien ihre eigenen Sauerstoffproduktionsanlagen bereitstellen können.
Verwendungszwecke. Sauerstoff hat so viele kommerzielle, industrielle und andere Verwendungszwecke, dass er in den Vereinigten Staaten stets zu den fünf wichtigsten Chemikalien gehört, was das Produktionsvolumen angeht. Im Jahr 1990 beispielsweise wurden in den Vereinigten Staaten etwa 18 Milliarden Kilogramm (39 Milliarden Pfund) des Elements hergestellt.
Die Verwendungszwecke von Sauerstoff lassen sich in vier große Kategorien einteilen: Metallurgie, Raketentechnik, chemische Synthese und Medizin. Bei der Verarbeitung von Eisenerz in einem Hochofen zum Beispiel wird Sauerstoff verwendet, um Koks (Kohlenstoff) in Kohlenmonoxid umzuwandeln. Das Kohlenmonoxid wiederum reduziert Eisenoxide zu reinem Eisenmetall. Sauerstoff wird dann in einem zweiten Schritt der Eisenverarbeitung im Bessemer-Konverter, am offenen Herd oder im Sauerstoff-Basis-Verfahren zur Umwandlung von „Roheisen“ in Stahl verwendet. In diesem Schritt wird der Sauerstoff verwendet, um mit dem überschüssigen Kohlenstoff, Silizium und den Metallen zu reagieren, die im Roheisen verbleiben und entfernt werden müssen, um Stahl zu erzeugen.
Eine weitere metallurgische Anwendung von Sauerstoff sind Brenner, die zum Schweißen und Schneiden verwendet werden. Die beiden gängigsten Brenner nutzen die Reaktion zwischen Sauerstoff und Wasserstoff (Knallgasbrenner) oder zwischen Sauerstoff und Acetylen (Acetylenbrenner). Beide Arten von Brennern erzeugen Temperaturen im Bereich von 3.000 °C oder mehr und können daher zum Schneiden oder Schweißen der meisten metallischen Werkstoffe verwendet werden.
In Form von LOX wird Sauerstoff in vielen Raketen und Flugkörpern als Oxidationsmittel eingesetzt. Der riesige externe Treibstofftank, der benötigt wird, um das Space Shuttle in den Weltraum zu bringen, enthält beispielsweise 550.000 Liter flüssigen Sauerstoff und 1.500.000 Liter flüssigen Wasserstoff. Wenn diese beiden Elemente in den Haupttriebwerken des Shuttles reagieren, sorgen sie für einen maximalen Schub von 512.000 Pfund.
Die chemische Industrie verbraucht jedes Jahr riesige Mengen an Sauerstoff für eine Vielzahl von chemischen Synthesereaktionen (Bildung). Eine der wichtigsten davon ist das Cracken von Kohlenwasserstoffen durch Sauerstoff. Unter den meisten Umständen führt das Erhitzen eines Kohlenwasserstoffs mit Sauerstoff zu einer Verbrennung, bei der Kohlendioxid und Wasser als Hauptprodukte entstehen. Wenn jedoch die Geschwindigkeit, mit der Sauerstoff in ein Kohlenwasserstoffgemisch eingeleitet wird, sorgfältig gesteuert wird, wird der Kohlenwasserstoff „gecrackt“ oder aufgebrochen, um andere Produkte wie Acetylen, Ethylen und Propylen zu erzeugen.
Auch verschiedene Arten von synthetischen Kraftstoffen können mit Sauerstoff als einem der Hauptreaktanten hergestellt werden. So wird beispielsweise Synthesegas hergestellt, indem Sauerstoff mit kontrollierter Geschwindigkeit durch ein Bett aus heißer Kohle oder Koks geleitet wird. Der Großteil des bei dieser Reaktion entstehenden Kohlendioxids wird zu Kohlenmonoxid reduziert, so dass das Endprodukt (das Synthesegas) hauptsächlich aus Kohlenmonoxid und Wasserstoff besteht.
Die wohl bekannteste medizinische Anwendung von Sauerstoff ist die Sauerstofftherapie, bei der Patienten mit Atembeschwerden reiner oder nahezu reiner Sauerstoff verabreicht wird. Die Sauerstofftherapie wird häufig bei chirurgischen Eingriffen, während der Geburt, bei der Genesung nach Herzinfarkten und bei der Behandlung von Infektionskrankheiten eingesetzt. In jedem Fall verringert die Versorgung mit reinem Sauerstoff die Belastung von Herz und Lunge und beschleunigt so die Genesung.
Reiner Sauerstoff oder mit Sauerstoff angereicherte Luft kann auch in Umgebungen bereitgestellt werden, in denen das Atmen schwierig sein kann. Flugzeuge, die in großen Höhen fliegen, haben natürlich immer einen Sauerstoffvorrat dabei, falls es Probleme mit der normalen Luftzufuhr des Schiffes gibt. Tiefseetaucher führen ebenfalls mit Sauerstoff angereicherte Luft mit sich oder lassen sie sich pumpen.
Einige Wasserreinigungs- und Kläranlagen verwenden Sauerstoff. Das Gas wird durch das Wasser gepumpt, um die Geschwindigkeit zu erhöhen, mit der natürlich vorkommende Bakterien organische Abfallstoffe abbauen. Es hat sich gezeigt, dass ein ähnliches Verfahren die Eutrophierung von Seen und Teichen verringert und in einigen Fällen sogar umkehrt. (Unter Eutrophierung versteht man die Auflösung von Nährstoffen in einem Wasserkörper. Das Wachstum der Wasserpflanzen und der Rückgang des gelösten Sauerstoffs sind die beiden wichtigsten Folgen dieses Prozesses).
Schließlich ist Sauerstoff für das gesamte tierische Leben auf der Erde unerlässlich. Ein Mensch kann einige Tage oder Wochen ohne Wasser oder Nahrung überleben, aber nicht länger als ein paar Minuten ohne Sauerstoff. Ohne Sauerstoff kämen die energieerzeugenden chemischen Reaktionen in den Zellen zum Erliegen, und der Mensch würde sterben.
Schwefel
Schwefel ist ein nichtmetallisches Element, das in vielen allotropen Formen (physikalisch oder chemisch unterschiedliche Formen desselben Stoffes) vorkommen kann. Die bekanntesten sind der rhombische und der monokline Schwefel. Beide sind leuchtend gelbe Feststoffe mit einem Schmelzpunkt von etwa 115°C (239°F). Eine dritte Form ist der plastische oder amorphe Schwefel. Es handelt sich um eine bräunliche Flüssigkeit, die entsteht, wenn rhombischer oder monokliner Schwefel geschmolzen wird.
Schwefel selbst hat überhaupt keinen Geruch. In dieser Hinsicht hat er jedoch einen schlechten Ruf, denn einige seiner häufigsten Verbindungen haben einen starken Geruch. Schwefeldioxid, eine dieser Verbindungen, hat auf jeden, der es einatmet, eine scharfe, erstickende Wirkung. Das „Feuer und Schwefel“ der Bibel war eine der schlimmsten Strafen, die sich ihre Autoren vorstellen konnten. Der Schwefel in diesem Ausdruck bezog sich auf brennenden Schwefel, oder Schwefeldioxid. Die Tatsache, dass Schwefel tief unter der Erde vorkommt und dass man Schwefeldioxid in den Dämpfen von Vulkanen riechen kann, hat die Vorstellung der Menschen von der Hölle noch weiter angeheizt.
Eine zweite Schwefelverbindung mit schlechtem Geruch ist Schwefelwasserstoff. Der starke Geruch von faulen Eiern ist auf das Vorhandensein dieser Verbindung zurückzuführen.
Vorkommen und Herstellung. Schwefel ist das sechzehnthäufigste Element in der Erdkruste. Er kommt sowohl als Element als auch in einer Vielzahl von Verbindungen vor. Als Element kommt er in sehr großen, unterirdischen Minen vor, am häufigsten entlang der Golfküste der Vereinigten Staaten sowie in Polen und Sizilien. Der Schwefel wird in diesen Minen mit Hilfe des Frasch-Verfahrens gewonnen. Bei diesem Verfahren wird überhitzter Dampf durch das äußerste von drei Rohren gepumpt. Durch das innerste Rohr wird Druckluft gepresst. Der überhitzte Dampf bringt den unterirdischen Schwefel zum Schmelzen, und die Druckluft drückt ihn durch das mittlere der drei Rohre nach oben an die Erdoberfläche.
Schwefel ist auch in Form von Mineralien und Erzen weit verbreitet. Viele davon liegen in Form von Sulfaten vor, darunter Gips (Calciumsulfat, CaSO 4 ), Baryt (Bariumsulfat, BaSO 4 ) und Bittersalz (Magnesiumsulfat, MgSO 4 ). Andere sind Metallsulfide, darunter Eisenkies (Eisensulfid, FeS 2 ), Bleiglanz (Bleisulfid, PbS), Zinnober (Quecksilbersulfid, HgS), Stibnit (Antimonsulfid, Sb 2 S 3 ) und Zinkblende (Zinksulfid, ZnS). Der Schwefel wird aus diesen Metallerzen durch starkes Erhitzen an der Luft gewonnen, wodurch der Schwefel in Schwefeldioxid umgewandelt und das reine Metall freigesetzt wird. Das Schwefeldioxid kann dann direkt zur Herstellung von Schwefelsäure verwendet werden, wo mehr als 90 Prozent des weltweit geförderten Schwefels landen.
Verwendung von Schwefel und seinen Verbindungen. Ein Teil des Schwefels wird direkt als Fungizid und Insektizid, in Streichhölzern, Feuerwerkskörpern und Schießpulver sowie bei der Vulkanisierung von Naturkautschuk (eine Behandlung, die Gummi Elastizität und Festigkeit verleiht) verwendet. Der größte Teil wird jedoch in eine Vielzahl von nützlichen Verbindungen umgewandelt.
Schwefelsäure ist bei weitem die wichtigste aller Schwefelverbindungen. Nahezu 90 Prozent des produzierten Schwefels wird zunächst in Schwefeldioxid und dann in Schwefelsäure umgewandelt. Die Säure steht unter den in den Vereinigten Staaten hergestellten Chemikalien stets an erster Stelle. Im Jahr 1990 wurden mehr als 40 Milliarden Kilogramm (89 Milliarden Pfund) Schwefelsäure hergestellt, mehr als 50 Prozent mehr als die zweitbeliebteste Chemikalie (Stickstoffgas). Schwefelsäure wird bei der Herstellung von Düngemitteln, Autobatterien, Erdölprodukten, Pigmenten, Eisen und Stahl und vielen anderen Produkten verwendet.
Der Schwefelkreislauf. Wie Stickstoff, Kohlenstoff und Phosphor durchläuft auch Schwefel die gasförmigen, flüssigen und festen Teile unseres Planeten in einer Reihe von kontinuierlichen Reaktionen, die als Schwefelkreislauf bekannt sind. Die wichtigsten Schritte im Schwefelkreislauf sind in der nebenstehenden Abbildung dargestellt.
Schwefel wird auf natürliche Weise bei Vulkanausbrüchen und durch Emissionen aus heißen Quellen erzeugt. Er gelangt vor allem in Form von Schwefeldioxid in die Atmosphäre und verbleibt dort in dieser Form oder, nach Reaktion mit Wasser, in Form von Schwefelsäure. Wenn es regnet oder schneit, wird der Schwefel als saurer Niederschlag zurück an die Erdoberfläche getragen.
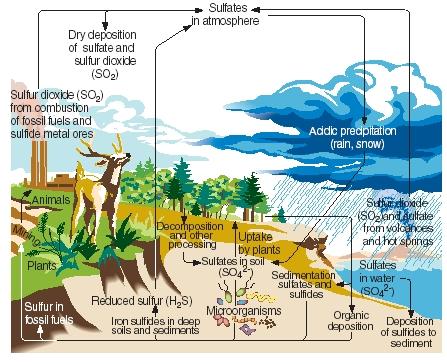
.)
Auf der Erdoberfläche reagieren Schwefeldioxid und Schwefelsäure mit Metallen und bilden Sulfate und Sulfide. Das Element wird auch von Pflanzen in einer Form aufgenommen, die als organischer Schwefel bekannt ist. Bestimmte Aminosäuren, die Verbindungen, aus denen Proteine hergestellt werden, enthalten Schwefel. Organischer Schwefel aus Pflanzen wird schließlich an Tiere weitergegeben, die diese Pflanzen fressen. Er wird wiederum von Pflanzenproteinen in tierische Proteine umgewandelt.
Wenn Pflanzen und Tiere absterben, gelangt der Schwefel zurück in den Boden, wo er von Mikroorganismen in Schwefelwasserstoff umgewandelt wird. Schwefelwasserstoffgas wird dann in die Atmosphäre zurückgeführt, wo es zu Schwefelsäure oxidiert wird.
Menschliche Aktivitäten beeinflussen den Schwefelkreislauf auf verschiedene Weise. Beim Abbau von Kohle und metallischen Erzen können beispielsweise Schwefel und Sulfide freigesetzt und in den Boden zurückgeführt werden. Auch bei der Verbrennung von Kohle, Erdöl und Erdgas wird häufig Schwefeldioxid in die Atmosphäre freigesetzt. Dieses Schwefeldioxid kommt zu der bereits aus natürlichen Quellen stammenden Menge hinzu, wodurch die Menge des sauren Niederschlags, der auf die Erdoberfläche fällt, stark ansteigt. Manche Menschen glauben, dass saurer Niederschlag (oder saurer Regen) für das Absterben von Bäumen und anderen Pflanzen, die Versauerung von Seen, die Meerestieren schadet, Schäden an Metall- und Steinstrukturen und andere Umweltschäden verantwortlich ist.
Selen, Tellur und Polonium
Selen und Tellur sind beides relativ seltene Elemente. Sie gehören zu den unteren zehn Prozent aller Elemente, was ihre Häufigkeit angeht. Sie kommen in der Erdkruste meist in Verbindung mit Erzen von Kupfer und anderen Metallen vor. Beide werden als Nebenprodukt bei der elektrolytischen Raffination von Kupfer gewonnen. Bei diesem Prozess sinken sie auf den Boden des Elektrolysebeckens, wo sie aus dem entstehenden Schlamm entfernt werden können.
Selen kommt in verschiedenen allotropen Formen vor (physikalisch oder chemisch unterschiedliche Formen desselben Stoffes), von denen die häufigste ein rotes Pulver ist, das an der Luft schwarz wird. Der Schmelzpunkt des Elements liegt bei 217°C (423°F), der Siedepunkt bei 685°C (1.265°F). Tellur ist ein silbrig-weißer Feststoff, der wie ein Metall aussieht (obwohl er eigentlich ein Metalloid ist). Sein Schmelzpunkt liegt bei 450 °C und sein Siedepunkt bei 990 °C.
Selen hat eine interessante Rolle in lebenden Organismen. In sehr geringen Konzentrationen ist es für die Gesundheit der meisten Tiere unerlässlich. Daher wird es häufig dem Tierfutter zugesetzt. In höheren Konzentrationen hat sich jedoch gezeigt, dass das Element schädliche Auswirkungen auf Tiere hat und zu missgebildeten Jungtieren und kranken Erwachsenen führt.
Selen wird hauptsächlich in der Elektronik und bei der Herstellung von Farbglas verwendet. In Fotokopiergeräten, Solarzellen, Fotozellen, Fernsehröhren und elektronischen Gleichrichtern und Relais (zur Steuerung des Stromflusses) wird Selen verwendet. Einige der schönsten farbigen Gläser, die von blassrosa bis zu leuchtenden Rottönen reichen, werden mit Selenverbindungen hergestellt.
Geringe Mengen von Tellur werden ebenfalls für die Herstellung von Farbglas verwendet. Mehr als 90 Prozent des Elements gehen jedoch in die Herstellung von Legierungen aus Eisen und anderen Metallen.
Polonium hat 27 Isotope, von denen alle radioaktiv sind. Es kommt in der Natur in Uranerzen vor, wo es das Endprodukt einer langen Reihe von Reaktionen ist, bei denen Uran einen radioaktiven Zerfall erfährt. Es ist eines der seltensten Elemente auf der Erde, mit einer Häufigkeit von nur etwa 3 × 10 -10 Teilen pro Million. Die Entdeckung von Polonium im Jahr 1898 durch die polnisch-französische Chemikerin Marie Curie (1867-1934) ist eine der dramatischsten Geschichten in der Geschichte der Wissenschaft. Sie verarbeitete tonnenweise Uranerz, um einige Milligramm des neuen Elements zu gewinnen, das sie dann nach ihrem Heimatland Polen benannte. Polonium findet nur begrenzte Verwendung in hochspezialisierten Stromerzeugungsgeräten, wie sie für Weltraumsatelliten und Raumsonden verwendet werden.