UTI – Ist der traditionelle Kulturtest obsolet?
Veröffentlichungsdatum: März 2020
Harnwegsinfektionen sind die häufigste Art von bakteriellen Infektionen,1 die in den Vereinigten Staaten jährlich für mindestens 11 Millionen Arztbesuche, 2 bis 3 Millionen Besuche in der Notaufnahme, 400.000 Krankenhausaufenthalte und etwa 2,3 Milliarden US-Dollar an Kosten im Gesundheitswesen verantwortlich sind.2,3,4,5
Diese enorme Belastung für die Patienten und das Gesundheitssystem nimmt weiter zu. So erhöhen beispielsweise die Alterung der Bevölkerung und die Verbreitung antimikrobiell resistenter Bakterien den Bedarf an Intensivpflege und die Sterblichkeit im Krankenhaus aufgrund von Harnwegsinfektionen.6,7
Solche Faktoren erhöhen die Notwendigkeit, Harnwegsinfektionen zu diagnostizieren und die antimikrobielle Therapie effizient und genau zu optimieren. Neue Testmethoden und unser wachsendes Verständnis des Mikrobioms der Harnwege werfen jedoch Fragen zur Relevanz der traditionellen Urinkultur auf. In diesem Artikel gebe ich einen Überblick über die wichtigsten Arten von Harnwegsinfektionen, aktuelle Ansätze für die Verwendung von Urinkulturen und Empfindlichkeitstests, neue Erkenntnisse über das Mikrobiom der Harnwege, neue kommerziell erhältliche Tests und künftige Ansätze für die Erkennung von Harnwegsinfektionen, einschließlich neuartiger Biomarker und Algorithmen für maschinelles Lernen.
Unkomplizierte versus komplizierte Harnwegsinfektionen
Die Unterscheidung zwischen unkomplizierten und komplizierten Harnwegsinfektionen ist ein wichtiger erster Schritt, um die Behandlung zu steuern. Unkomplizierte Harnwegsinfektionen gehören zu den am häufigsten behandelten Infektionsarten in der Primärversorgung. Frauen sind am stärksten gefährdet, mit einer Lebenszeitinzidenz von annähernd 50 % und einer Rezidivrate von etwa 33 %.8
Die Mehrzahl der Patienten mit unkomplizierten Harnwegsinfektionen sind prämenopausale Frauen, die nicht schwanger sind und wenige oder keine Begleiterkrankungen haben. Diese Patienten weisen typischerweise Symptome einer Blasenentzündung auf, wie Dysurie, Häufigkeit und Dringlichkeit.9 Suprapubische Schmerzen und Hämaturie sind selten, und eine Pyelonephritis liegt nicht vor.
Komplizierte Harnwegsinfektionen betreffen typischerweise Patienten beiderlei Geschlechts, die strukturelle oder funktionelle Anomalien der Harnwege aufweisen.9 Diese Patienten hatten häufig frühere urologische Eingriffe, kürzliche Antibiotikaexposition, kürzliche oder langfristige Katheterisierung oder kürzliche oder aktuelle Krankenhausaufenthalte (im Krankenhaus erworbene Harnwegsinfektionen). Weitere Risikogruppen sind schwangere Frauen, Patienten mit Diabetes mellitus und Patienten mit anderen immunschwächenden Erkrankungen.
Patienten mit komplizierten Harnwegsinfektionen zeigen typischerweise Symptome einer Pyelonephritis, einschließlich Fieber, Schüttelfrost und Flankenschmerzen, mit oder ohne Übelkeit. Sie können eine bestätigte oder vermutete Infektion(en) mit virulenteren Bakterien hinter sich haben. Urinkulturen können eine vielfältige Mikrobiota und überdurchschnittliche Muster antimikrobieller Resistenzen aufzeigen. Leider können diese beiden Faktoren die Wirksamkeit einer antimikrobiellen Therapie untergraben.
Wann sollten Urinkulturen und Empfindlichkeit in Betracht gezogen werden
Historisch gesehen bestand der diagnostische Goldstandard für Harnwegsinfektionen darin, eine Standard-Urinkultur durchzuführen (d. h. 1 Mikroliter Mittelstrahlurin auf 5 %ige Schafsblut- und McConkey-Agare aufzutragen und diese aerob zu bebrüten).1 In diesem Zusammenhang wurde eine Harnwegsinfektion definiert als das Vorhandensein eines isolierten, bekannten Uropathogens in einer Konzentration von >105 KBE/ml oder >102 KBE/ml bei einem symptomatischen Patienten. Angesichts der hohen Prävalenz von Harnwegsinfektionen und der Tatsache, dass eine Urinkultur kein „Point-of-Care“-Test ist, ist es eine Überlegung wert, wann es möglich ist, auf eine Kultur zu verzichten, ohne die Behandlungsergebnisse zu beeinträchtigen.
In den aktuellen Richtlinien der Infectious Diseases Society of America (IDSA) wird eine routinemäßige Standard-Urinkultur bei Patienten mit Verdacht auf unkomplizierte Harnwegsinfektionen nicht empfohlen.10 Es gibt zahlreiche Belege dafür, dass die Urinanalyse in dieser Situation aussagekräftig ist. In einer Studie wiesen etwa 94 % der Patienten mit einer negativen Urinanalyse auch eine negative Kultur auf.11 In einer retrospektiven Längsschnittstudie mit fast 21 000 ambulanten Patientinnen war eine negative Urinanalyse mit einer 2,5-fach höheren Wahrscheinlichkeit einer negativen Kultur (<103 KBE/ml) verbunden als eine positive Urinanalyse.12 Bei Patienten mit rezidivierenden Symptomen einer Harnwegsinfektion waren eine vorherige negative Urinanalyse oder Urinkultur oder eine aktuelle vaginale Reizung oder Ausfluss mit einer statistisch signifikanten Erhöhung der Wahrscheinlichkeit einer negativen Kultur verbunden.
Die Leukozytenesterase ist besonders aussagekräftig bei der Beurteilung von vermuteten unkomplizierten Harnwegsinfektionen. In einer großen retrospektiven Studie mit mehr als 8.500 solchen Patienten sagte ein negatives Ergebnis für Leukozytenesterase ein negatives Urinkulturergebnis mit 95 %iger Genauigkeit voraus (negativer Vorhersagewert, 0,95), während negative Ergebnisse für Leukozytenesterase und Nitrat zusammen nur geringfügig genauer waren (kombinierter negativer Vorhersagewert, 0,96).13 Bemerkenswert ist, dass ein negatives Nitratergebnis allein deutlich weniger zuverlässig ein negatives Kulturergebnis vorhersagte (negativer Vorhersagewert, 0,87).
Für Patienten mit unkomplizierten Harnwegsinfektionen empfehlen die IDSA-Leitlinien die Auswahl zwischen den folgenden Medikamenten für eine empirische antimikrobielle Therapie:10
– Nitrofurantoin 100mg zweimal täglich (BID) für 5 Tage
– Trimethoprim/Sulfamethoxazol (Bactrim DS) für 3 Tage, wenn die lokalen Resistenzraten <20% betragen (wenn Sie nicht bereits Zugang zu diesen Daten haben, sollten Sie sich an die lokalen, regionalen oder staatlichen Gesundheitsämter wenden)
– Fosfomycin (3-Gramm-Einzeldosis)
– Beachten Sie, dass Fluorchinolone wie Ciprofloxacin aufgrund hoher Resistenzraten in einigen Gebieten nicht mehr für unkomplizierte Harnwegsinfektionen empfohlen werden
Außerdem sollte sich die Auswahl der antimikrobiellen Therapie für unkomplizierte Harnwegsinfektionen an den lokalen Mustern der antimikrobiellen Resistenz und der besten, fundierten Vermutung des Arztes hinsichtlich des wahrscheinlichsten Uropathogens orientieren. In einer Studie mit mehr als 9.000 Frauen mit kulturell bestätigten unkomplizierten Harnwegsinfektionen waren 19 % der Isolate resistent gegen Trimethoprim-Sulfamethoxazol und 12 % gegen Nitrofurantoin (10 % waren resistent gegen Ciprofloxacin, das für die empirische Therapie nicht mehr empfohlen wird).14 Signifikante Prädiktoren für eine Resistenz gegen antimikrobielle Mittel waren u. a. das Wohnen in einer Postleitzahl mit überdurchschnittlich hohen Raten antimikrobieller Resistenzen, eine Infektion mit einem resistenten Uropathogen in der Vorgeschichte oder die Verschreibung einer antimikrobiellen Therapie innerhalb der letzten zwei Jahre. Auf der Grundlage dieser Daten entwickelten die Forscher einen Algorithmus, der in 92 % der Fälle eine angemessene antimikrobielle Therapie auswählte und damit die Auswahlquote des Anbieters von 87,5 % übertraf.
Zusammenfassend lässt sich sagen, dass bei Patienten mit unkomplizierten Harnwegsinfektionen eine herkömmliche Urinkultur nicht überflüssig ist, aber in den meisten Fällen ist sie unnötig.
Bei Patienten mit Verdacht auf komplizierte Harnwegsinfektionen sollte der Arzt die initiale (empirische) antimikrobielle Therapie auf der Grundlage historischer Kultur- und Empfindlichkeitsdaten, sofern verfügbar, sowie der aktuellen Ergebnisse der Urinanalyse und der lokalen Muster der antimikrobiellen Resistenz auswählen. Wenn die Urinanalyse negativ ausfällt und der Patient in der Vorgeschichte negative Kulturen hatte, besteht nach neueren Daten eine 87%ige Wahrscheinlichkeit, dass die gegenwärtigen Symptome nicht durch eine Harnwegsinfektion verursacht werden.12 Diese Patienten sollten auf andere Ursachen für ihre Symptome untersucht werden, wie z.B. ein chronisches Beckenschmerzsyndrom (CPPS) oder Tumore der Harnwege. Wenn die Urinanalyse positiv ist, empfehle ich, empirisch zu behandeln und eine Urinkultur und -sensitivität anzuordnen, um die Behandlung gegebenenfalls zu modifizieren.
Der Urin ist nicht steril
Bis vor kurzem bestand das Paradigma für die Behandlung sowohl unkomplizierter als auch komplizierter Infektionen darin, Mikroorganismen aus den Harnwegen zu eliminieren. Fachleute haben inzwischen erkannt, dass dieser Ansatz durch zwei wichtige Faktoren eingeschränkt wird: Mikroorganismen sind auch im asymptomatischen (gesunden) Harntrakt vorhanden, und Standardkulturen sind relativ unempfindlich für den Nachweis von Mikroorganismen im Urin. 5 In einer kürzlich durchgeführten Studie führten Forscher eine quantitative PCR der 16S ribosomalen RNA von 16 Urinproben gesunder Männer und Frauen im Alter von 26 bis 90 Jahren durch.16 Fünf Proben wurden positiv auf ein bakterielles Phylum und eine bis sechs Gattungen getestet, während die übrigen Proben durchschnittlich fünf Phyla und acht bis 36 Gattungen enthielten. In einer anderen Studie führten Forscher eine Hochdurchsatz-PCR-Sequenzierung von Urinproben von acht Frauen durch, die alle negative Standardurinkulturen aufwiesen.17 Alle Proben waren polymikrobiell und wiesen eine beträchtliche Variabilität zwischen den Proben auf: 45 einzigartige Bakterienarten wurden identifiziert, von denen neun mit Harnwegsinfektionen in Verbindung gebracht wurden und 20 ein unbekanntes pathogenes Potenzial aufwiesen. Ähnliche Studien haben diesen Befund bestätigt,18 was darauf hindeutet, dass der Urin gesunder Personen häufig Bakterien enthält, die mit Standard-Urinkulturen nicht nachgewiesen werden können.
In einer anderen Studie wurde mit Hilfe der erweiterten quantitativen Urinkultur (EQUC) genauer untersucht, ob die in den Urinproben nachgewiesenen Bakterien lebensfähig waren.19 Bei dieser Methode werden größere Urinmengen ausplattiert, die Proben unter einer größeren Bandbreite von Wachstumsbedingungen bebrütet und längere Inkubationszeiten verwendet. Bei den 65 Urinproben, die mit EQUC untersucht wurden, wuchsen in 80 % der Fälle Bakterien, von denen 92 % mit der Standardkultur nicht nachgewiesen werden konnten. Insgesamt wurden 35 Gattungen identifiziert, von denen Lactobacillus, Corynebacterium, Streptococcus, Actinomyces und Staphylococcus am häufigsten vorkamen. Die meisten Bakterienarten vermehrten sich in einer Anzahl, die unter der Nachweisgrenze von Standard-Urinkulturprotokollen lag. Diese Ergebnisse wurden durch eine andere, kürzlich durchgeführte Studie mit 150 Erwachsenen (von denen die Hälfte über Harnsymptome berichtete) bestätigt, in der mit EQUC 182 Uropathogene nachgewiesen wurden – dreimal so viele wie mit Standardkulturen.20
Insgesamt bestätigen die Ergebnisse dieser Studien, dass sowohl bei gesunden Menschen als auch bei Patienten mit Harnsymptomen eine vielfältige Mikrobiota im Urin vorhanden ist und dass Standard-Urinkulturmethoden relativ unempfindlich für die Charakterisierung dieses Mikrobioms, einschließlich der Uropathogene, sind. Standardkulturen simulieren auch nicht zuverlässig Biofilme, wie sie sich z. B. in Harnkathetern bilden, und die endgültigen Ergebnisse von Standardkulturen und Empfindlichkeitstests benötigen Tage, bis sie gemeldet werden.11,21 Offensichtlich gibt es Raum für Verbesserungen.
Neue, im Handel erhältliche Tests für Harnwegsinfektionen
Drei im Handel erhältliche Urintests weisen Uropathogene mit höherer Empfindlichkeit als Standard-Urinkulturen nach und suchen auch schnell nach Anzeichen für eine antimikrobielle Resistenz (Tabelle 1).18,19,22 Zu den potenziellen Vorteilen dieser Tests gehören die schnellere Identifizierung von Krankheitserregern, genauere Empfindlichkeitsergebnisse und eine individualisierte Behandlung, die theoretisch alle die Ergebnisse für die Patienten verbessern können.23,24,25
Der Vikor Urine-ID™-Test ist ein PCR-basierter Test, der mehrere Bakterienarten nachweisen und außerdem bis zu 30 bakterielle Gene identifizieren kann, die für die Resistenz gegen antimikrobielle Mittel kodieren.26 Die Testergebnisse liegen in etwa 12 bis 24 Stunden vor (Tabelle 1). Zusammen mit den Testergebnissen stellt der Hersteller Informationen zu regionalen antimikrobiellen Empfindlichkeitsmustern, den Wirkungsspektren von Antibiotika, den Medikamentenkosten und den einschlägigen Leitlinien der US-amerikanischen Food and Drug Administration (FDA) zur Verfügung.
Das MicroGenDX UTI Urinalysis Kit ist ein zweistufiger Test.27 Zunächst wird mittels quantitativer PCR auf 16 Bakterientypen sowie Candida albicans getestet, wobei die Ergebnisse innerhalb von 24 Stunden vorliegen. Zweitens wird mittels Next-Generation-Sequencing (NGS) die Mikrobiota-DNA aus der Urinprobe mit einer Datenbank von mehr als 30.000 Mikrobenarten verglichen, wobei die Ergebnisse innerhalb von 3 bis 5 Tagen vorliegen (Tabelle 1). Nach Angaben des Herstellers identifiziert das UTI Urinalysis Kit alle Mikroben in einer Urinprobe mit 99,9 % Genauigkeit.
Tabelle 1. Übersicht über neuartige kommerziell verfügbare Tests für Harnwegsinfektionen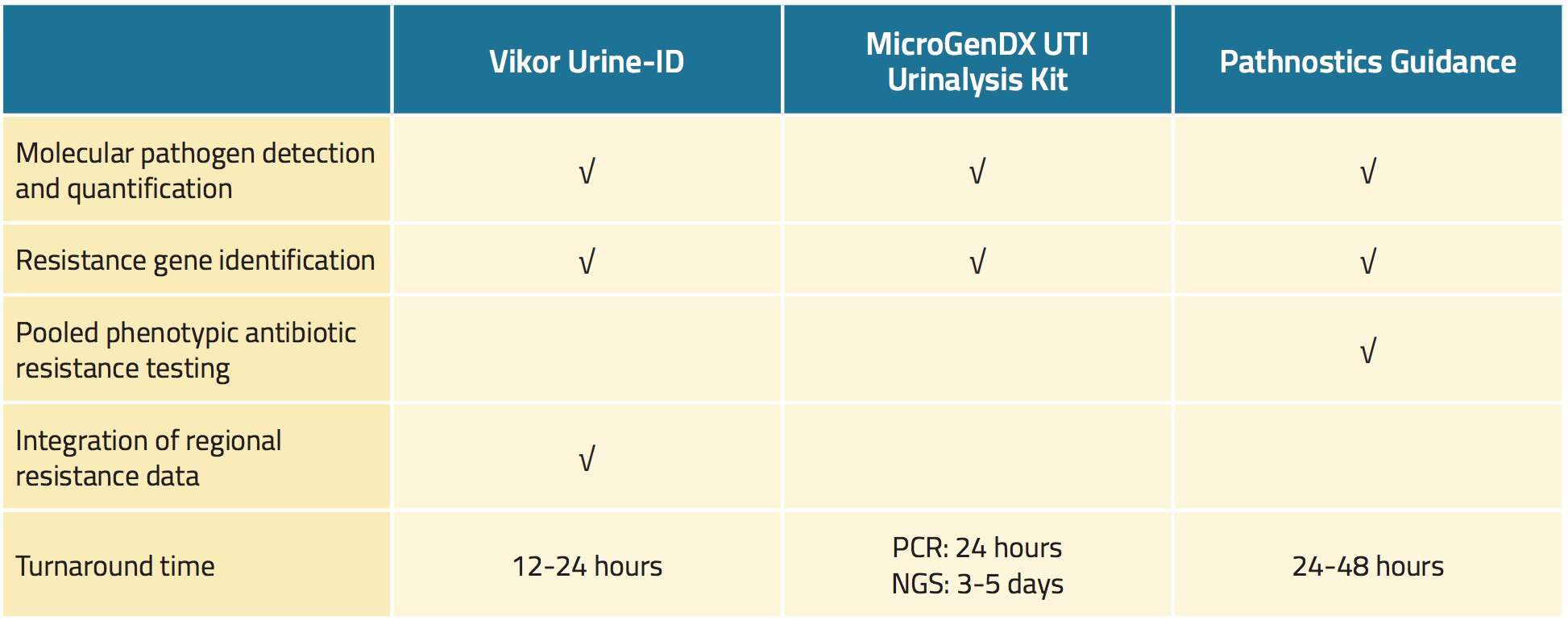
Der Pathnostics Guidance Assay besteht aus einer Reihe neuartiger Urintests für Patienten mit Prostatitis, interstitieller Zystitis und wiederkehrenden Harnwegsinfektionen.28 Der Assay für Harnwegsinfektionen verwendet PCR zum Screening auf 45 Erreger und 38 Resistenzgene. Der Pathnostics Guidance-Assay liefert auch phänotypische Daten und gepoolte Ergebnisse zur Empfindlichkeit gegenüber antimikrobiellen Mitteln. Für den Test kann entweder entleerter oder Katheterurin verwendet werden, der bis zu 5 Tage bei Raumtemperatur gelagert werden kann. Die Ergebnisse liegen innerhalb von 24 bis 28 Stunden vor.
Ein Vorbehalt muss erwähnt werden. Wie bereits erwähnt, können diese hochempfindlichen Tests Bakterien im Urin von asymptomatischen Personen und von Personen nachweisen, deren Symptome nicht auf eine Harnwegsinfektion zurückzuführen sind. Daher sollten Kliniker ihre Behandlungsentscheidungen nicht allein auf Testergebnisse stützen. Dies kann für die Patienten nachteilige Folgen haben. In einer Studie mit 673 Frauen jungen und mittleren Alters mit asymptomatischer Bakteriurie und einer Vorgeschichte rezidivierender Harnwegsinfektionen erhielt die Hälfte der Patientinnen eine antimikrobielle Therapie, während der Rest nicht behandelt wurde.22 Bei der Nachbeobachtung nach sechs und zwölf Monaten war die antimikrobielle Therapie mit einem statistisch signifikanten Anstieg der Raten des Wiederauftretens von Harnsymptomen verbunden. Um den übermäßigen Einsatz antimikrobieller Mittel und die damit verbundenen Nebenwirkungen, Kosten und die Selektion von Antibiotikaresistenzen zu vermeiden, ist es von entscheidender Bedeutung, dass die Kliniker die Testergebnisse im Kontext des Gesamtrisikos und der Vorgeschichte der Patienten in Bezug auf Harnwegsinfektionen sowie der aktuellen klinischen Präsentation bewerten.
Zukünftige Richtungen für urinbasierte Tests
Auch wenn kürzlich zugelassene Tests die Erkennung und Behandlung von Harnwegsinfektionen im Vergleich zu Standardkulturen allein erheblich verbessern werden, suchen Forscher weiterhin nach Möglichkeiten zur Verbesserung der Diagnose, des Erregernachweises, der Quantifizierung der Empfindlichkeit gegenüber antimikrobiellen Mitteln und der Behandlungsalgorithmen. Beispiele hierfür sind der Einsatz von Techniken des maschinellen Lernens, zusammengesetzte Analysen neuartiger Biomarker und Tests für zelluläre Proteinsignaturen.
Algorithmen des maschinellen Lernens haben sich schon früh als vielversprechend erwiesen, um die Erkennung und Bewertung von Patienten mit unkomplizierten Harnwegsinfektionen zu verbessern. In einer Studie wurden beispielsweise 17 klinische Variablen und 42 immunologische Variablen ausgewertet, um die besten Prädiktoren für die Ergebnisse einer Urinkultur zu ermitteln. Die Trübung des Urins war der beste klinische Prädiktor mit einem positiven Vorhersagewert von 0,65 (was bedeutet, dass das Vorhandensein einer Urintrübung eine kulturpositive Probe mit einer Genauigkeit von 65 % identifiziert) und einem negativen Vorhersagewert von 0.79 (was bedeutet, dass das Fehlen einer Urintrübung eine kulturnegative Probe mit 79 % Genauigkeit identifizierte).29 Die Urintrübung war also relativ unempfindlich, zeigte aber eine angemessene Spezifität für den Nachweis einer kulturpositiven Probe. Vier Urin-Biomarker – Matrix-Metallopeptidase 9, Neutrophile Gelatinase-assoziiertes Lipocalin, Interleukin (IL)-8 und IL-1β – erreichten zusammen einen wesentlich höheren positiven prädiktiven Wert von 0,82 und einen vergleichbaren negativen prädiktiven Wert von 0,76. Obwohl die Kombination dieser vier Urin-Biomarker mit der Urintrübung diese Vorhersagewerte nicht weiter verbesserte, deuteten die Studienergebnisse darauf hin, dass Algorithmen des maschinellen Lernens die meisten Patienten mit unkomplizierten Harnwegsinfektionen zuverlässig identifizieren können.29
Wenn die Modelle des maschinellen Lernens weiter verfeinert werden, könnten sich ihre Vorhersagewerte verbessern, was die Diagnose und Behandlung von Harnwegsinfektionen in gefährdeten Bevölkerungsgruppen weiter verbessern und gleichzeitig die diagnostische Arbeitsbelastung verringern könnte. In einer kürzlich durchgeführten großen Studie wurden beispielsweise mehr als 212.000 Berichte über Urinmikroskopie-, Kultur- und Empfindlichkeitsergebnisse aus drei Krankenhäusern und ambulanten Diensten in Großbritannien analysiert.30 Spezielle Algorithmen für maschinelles Lernen wurden für Hochrisiko-Untergruppen wie Schwangere, Kinder und Personen mit persistierenden oder wiederkehrenden Harnwegsinfektionen entwickelt. Durch maschinelles Lernen wurden ca. 95 % der kulturpositiven Proben erkannt, wobei der mit der Urinkultur verbundene Arbeitsaufwand um ca. 41 % reduziert und eine um ca. 24 % höhere Spezifität als bei einem heuristischen Modell auf der Grundlage der Anzahl der weißen Blutkörperchen und Bakterien erreicht wurde. Diese Ergebnisse sind besonders bemerkenswert in einer Zeit, in der die Bevölkerungsalterung und das Auftreten antimikrobiell resistenter Bakterien die Notwendigkeit einer effizienten und genauen Erkennung behandlungsbedürftiger Harnwegsinfektionen erhöhen.
Rezidivierende Harnwegsinfektionen (historisch definiert als mindestens zwei Harnwegsinfektionen in den letzten sechs Monaten oder mehr als drei Infektionen innerhalb des letzten Jahres) betreffen etwa 50 % der Frauen über 55 Jahre und 27 % der jüngeren Frauen.31, 32 Aktuelle Leitlinien fordern ein intensives Management mit Maßnahmen wie prophylaktische antimikrobielle Therapie, Einschränkung der Verwendung von Spermiziden, Entleerung nach dem Geschlechtsverkehr, immunologische Prophylaxe mit OM-89, vaginale Impfung mit Urovac und die Verwendung von vaginalen Östrogencremes oder -ringen bei Frauen nach der Geburt.31, 33 Analysen von Serum- und Urin-Biomarkern könnten dazu beitragen, besser vorherzusagen, welche Patientinnen rezidivierende Harnwegsinfektionen entwickeln werden, damit sie früher und gezielter behandelt werden können.32 Zu den relevanten Biomarkern für wiederkehrende Harnwegsinfektionen gehören verringerte Serumspiegel von Vitamin D und prostataspezifischem Antigen, erhöhte Serumspiegel von Immunglobulinen, Granulozyten-Kolonie-stimulierendem Faktor, Makrophagen-Kolonie-stimulierendem Faktor und IL-5, während zu den relevanten Biomarkern im Urin erhöhte Spiegel von IL-8 und verringerte Spiegel von Nervenwachstumsfaktor und neutrophilem Gelatinase-assoziiertem Lipocalin gehören.
Zu den künftigen Diagnosemöglichkeiten könnten auch Biomarker-Assays gehören, die den Bedarf an Urinkulturen ergänzen oder verringern. Ein idealer Test wäre so schnell und kostengünstig wie ein Urin-Peilstabtest, aber präziser und genauer. Potenzielle Kandidaten sind Trimethylamin und Acetat, die Marker für den bakteriellen Stoffwechsel sind, sowie Xanthinoxidase und Myeloperoxidase, die enzymatische Biomarker sind.34
Künftige Tests könnten auch das Urin-Exosom als potenziellen Biomarker für Harnwegsinfektionen untersuchen. Das Exosom besteht aus kleinen extrazellulären Bläschen, die zelluläre Proteine transportieren. In einer Studie waren die Urinproteine Akt (ein intrazelluläres Signalprotein) und CD9 (ein intrazelluläres Transmembranprotein) bei Frauen mit Harnwegsinfektionen im Vergleich zu Frauen mit asymptomatischer Bakteriurie signifikant erhöht, und die Werte beider Proteine gingen nach einer antimikrobiellen Therapie signifikant zurück.35 Die Ergebnisse solcher Studien könnten eines Tages die Entwicklung kommerzieller Tests erleichtern, die das Urin-Exosom bewerten, um die Entscheidungsfindung bei der Behandlung zu unterstützen.
Zusammenfassung
Die Bewertung und Behandlung von Harnwegsinfektionen ist ein wesentlicher Bestandteil der urologischen Praxis. Bei unkomplizierten Harnwegsinfektionen ist eine Urinkultur in der Regel überflüssig, und eine empirische Behandlung gemäß den aktuellen IDSA-Richtlinien ist angemessen. Eine empirische Therapie auf der Grundlage historischer Kultur- und Sensitivitätsergebnisse ist auch bei komplizierten Harnwegsinfektionen angemessen, sollte aber auf der Grundlage der aktuellen Kultur- und Sensitivitätsergebnisse modifiziert werden. Wiederkehrende Harnwegsinfektionen können intensive therapeutische und verhaltenstherapeutische Interventionen erforderlich machen.
Dies sind zwar unsere derzeit besten Praktiken, aber sie lassen noch viel Raum für Verbesserungen, insbesondere wenn man die jüngsten Beweise für das Vorhandensein eines Mikrobioms der Harnwege und die Grenzen des Standardscreenings und der Kultur berücksichtigt. Es besteht ein Bedarf an schnellen, zuverlässigen Tests, um Uropathogene besser zu erkennen, eine klinisch bedeutsame Dysbiose im Urin von einer klinisch inkonsequenten Bakteriurie zu unterscheiden und die antimikrobielle Therapie auf der Grundlage personalisierter Resistenzdaten zu steuern. Empfindlichkeitstests auf der Grundlage von quantitativer PCR und Sequenzierung der nächsten Generation sind jetzt verfügbar. In Zukunft könnte auch der Einsatz verbesserter quantitativer Urinkulturmethoden die klinische Versorgung verbessern. Die Forscher evaluieren auch Algorithmen des maschinellen Lernens, die Serum- und Urin-Biomarker sowie andere klinische Variablen einbeziehen, um Harnwegsinfektionen effektiver zu erkennen, Rückfälle vorherzusagen und den diagnostischen Aufwand zu verringern. Die Einbeziehung dieser neuartigen Ansätze in lokale Resistenz- und Krankenhausrückübernahmedaten könnte ihren Nutzen erhöhen. Das Endziel ist die Entwicklung empfindlicher, spezifischer, kosteneffizienter Tests und praktischer Algorithmen, die das Management und die Ergebnisse für die Patienten verbessern.
Geschrieben von: Edward Schaeffer, MD, Ph.D., Vorsitzender, Abteilung für Urologie, Feinberg School of Medicine, Programmdirektor, Genitourinäres Onkologieprogramm, Robert H. Lurie Comprehensive Cancer Center, Northwestern University, Chicago, Illinois
1. Schaeffer, AJ., Matulewicz, RS., & Klumpp, DJ. (2016). Infections of the Urinary Tract. In AJ. Wein, & et al (Eds.), Campbell-Walsh Urology, Eleventh Edition Philadelphia: Elsevier-Saunders.
2. Schappert, S. M., und E. A. Rechtsteiner. „Ambulatory medical care utilization estimates for 2007“. Vital and Health Statistics. Series 13, Data from the National Health Survey 169 (2011): 1-38.
3. Foxman, Betsy. „Urinary tract infection syndromes: occurrence, recurrence, bacteriology, risk factors, and disease burden.“ Infectious disease clinics of North America 28, no. 1 (2013): 1-13.
4. Foxman, Betsy. „The epidemiology of urinary tract infection.“ Nature Reviews Urology 7, no. 12 (2010): 653.
5. Simmering, Jacob E., Fan Tang, Joseph E. Cavanaugh, Linnea A. Polgreen, and Philip M. Polgreen. „Der Anstieg der Krankenhausaufenthalte für Harnwegsinfektionen und die damit verbundenen Kosten in den Vereinigten Staaten, 1998-2011.“ In: Offenes Forum Infektionskrankheiten, Bd. 4, Nr. 1. Oxford University Press, 2017.
6. Nguyen, Hoa Q., Nga TQ Nguyen, Carmel M. Hughes, and Ciaran O’Neill. „Trends und Auswirkungen der antimikrobiellen Resistenz bei älteren stationären Patienten mit Harnwegsinfektionen (UTIs): A national retrospective observational study“. PloS one 14, no. 10 (2019).
7. Critchley, Ian A., Nicole Cotroneo, Michael J. Pucci, and Rodrigo Mendes. „The burden of antimicrobial resistance among urinary tract isolates of Escherichia coli in the United States in 2017.“ PloS one 14, no. 12 (2019).
8.Gupta, Kalpana, and Barbara W. Trautner. „Diagnosis and management of recurrent urinary tract infections in non-pregnant women.“ Bmj 346 (2013): f3140.
9. Tan, Chee Wei, und Maciej Piotr Chlebicki. „Urinary tract infections in adults.“ Singapore medical journal 57, no. 9 (2016): 485.
10. Gupta, Kalpana, Thomas M. Hooton, Kurt G. Naber, Björn Wullt, Richard Colgan, Loren G. Miller, Gregory J. Moran et al. „International clinical practice guidelines for the treatment of acute uncomplicated cystitis and pyelonephritis in women: a 2010 update by the Infectious Diseases Society of America and the European Society for Microbiology and Infectious Diseases.“ Clinical Infectious Diseases 52, no. 5 (2011): e103-e120.
11. Huang, Bin, Lei Zhang, Weizheng Zhang, Kang Liao, Shihong Zhang, Zhiquan Zhang, Xingyan Ma et al. „Direct detection and identification of bacterial pathogens from urine with optimized specimen processing and enhanced testing algorithm.“ Journal of clinical microbiology 55, no. 5 (2017): 1488-1495.
12. Cohen, Jason E., Emily M. Yura, Liqi Chen, and Anthony J. Schaeffer. „Predictive Utility of Prior Negative Urine Cultures in Women with Suspected Recurrent Uncomplicated Urinary Tract Infections.“ The Journal of Urology 202, no. 5 (2019): 979-985.
13. Marques, Alexandre Gimenes, Jacyr Pasternak, Márcio dos Santos Damascena, Carolina Nunes França, und Marinês Dalla Valle Martino. „Die Leistung des Dipstick-Screening-Tests als Prädiktor für eine negative Urinkultur“. Einstein (São Paulo) 15, no. 1 (2017): 34-39.
14. Cohen, Jason E., Liqi Chen, and Anthony J. Schaeffer. „Algorithmen, die frühere Resistenzen, frühere antimikrobielle Verordnungen und den Wohnort der Patientin berücksichtigen, verbessern die empirische Therapie bei Frauen mit unkomplizierten Harnwegsinfektionen.“ Urology 137 (2020): 72-78.
15. Finucane, Thomas E. „‚Urinary tract infection‘ and the microbiome.“ The American Journal of Medicine 130, no. 3 (2017): e97-e98.
16. Lewis, Debbie Ann, Richard Brown, Jon Williams, Paul White, Susan Kim Jacobson, Julian Marchesi, und Marcus John Drake. „The human urinary microbiome; bacterial DNA in voided urine of asymptomatic adults.“ Frontiers in cellular and infection microbiology 3 (2013): 41.
17. Siddiqui, Huma, Alexander J. Nederbragt, Karin Lagesen, Stig L. Jeansson, and Kjetill S. Jakobsen. „Bewertung der Diversität der weiblichen Urinmikrobiota durch Hochdurchsatz-Sequenzierung von 16S rDNA-Amplikonen“. BMC Microbiology 11, no. 1 (2011): 244.
18. Wolfe, Alan J., Evelyn Toh, Noriko Shibata, Ruichen Rong, Kimberly Kenton, MaryPat FitzGerald, Elizabeth R. Mueller et al. „Evidence of uncultivated bacteria in the adult female bladder.“ Journal of clinical microbiology 50, no. 4 (2012): 1376-1383.
19. Hilt, Evann E., Kathleen McKinley, Meghan M. Pearce, Amy B. Rosenfeld, Michael J. Zilliox, Elizabeth R. Mueller, Linda Brubaker, Xiaowu Gai, Alan J. Wolfe, und Paul C. Schreckenberger. „Urin ist nicht steril: Einsatz verbesserter Urinkulturtechniken zum Nachweis der residenten Bakterienflora in der Blase erwachsener Frauen“. Journal of clinical microbiology 52, no. 3 (2014): 871-876.
20. Price, Travis K., Tanaka Dune, Evann E. Hilt, Krystal J. Thomas-White, Stephanie Kliethermes, Cynthia Brincat, Linda Brubaker, Alan J. Wolfe, Elizabeth R. Mueller, and Paul C. Schreckenberger. „The clinical urine culture: enhanced techniques improve detection of clinically relevant microorganisms“. Journal of clinical microbiology 54, no. 5 (2016): 1216-1222.
21. Sathiananthamoorthy, Sanchutha, James Malone-Lee, Kiren Gill, Anna Tymon, Trang K. Nguyen, Shradha Gurung, Linda Collins et al. „Reassessment of routine midstream culture in diagnosis of urinary tract infection.“ Journal of clinical microbiology 57, no. 3 (2019): e01452-18.
22. Cai, Tommaso, Sandra Mazzoli, Nicola Mondaini, Francesca Meacci, Gabriella Nesi, Carolina D’Elia, Gianni Malossini, Vieri Boddi, und Riccardo Bartoletti. „Die Rolle der asymptomatischen Bakteriurie bei jungen Frauen mit rezidivierenden Harnwegsinfektionen: behandeln oder nicht behandeln“. Clinical infectious diseases 55, no. 6 (2012): 771-777.
23. Lehmann, Lutz E., Stefan Hauser, Thomas Malinka, Sven Klaschik, Stefan U. Weber, Jens-Christian Schewe, Frank Stüber, and Malte Book. „Schneller qualitativer Erregernachweis bei Harnwegsinfektionen mittels SeptiFast® Real-Time PCR“. PLoS One 6, no. 2 (2011).
24. Schmidt, K., K. K. Stanley, R. Hale, L. Smith, J. Wain, J. O’grady, and D. M. Livermore. „Evaluation of multiplex tandem PCR (MT-PCR) assays for the detection of bacterial resistance genes among Enterobacteriaceae in clinical urines“. Journal of Antimicrobial Chemotherapy 74, no. 2 (2019): 349-356.
25. Barczak, Amy K., James E. Gomez, Benjamin B. Kaufmann, Ella R. Hinson, Lisa Cosimi, Mark L. Borowsky, Andrew B. Onderdonk et al. „RNA signatures allow rapid identification of pathogens and antibiotic susceptibilities.“ Proceedings of the national academy of sciences 109, no. 16 (2012): 6217-6222.
26. Urine-IDTM – Vikor Scientific. https://www.vikorscientific.com/test-menu/urine-id/. Accessed February 15, 2020.
27. UTI Urine Kit – Insurance | MicroGen Diagnostics. https://microgendx.com/product/urine-kit-ins/. Accessed February 15, 2020.
28. Guidance – Pathnostics. https://www.pathnostics.com/physicians/tests/guidance/. Accessed February 15, 2020.
29. Gadalla, Amal AH, Ida M. Friberg, Ann Kift-Morgan, Jingjing Zhang, Matthias Eberl, Nicholas Topley, Ian Weeks et al. „Identification of clinical and urine biomarkers for uncomplicated urinary tract infection using machine learning algorithms.“ Scientific Reports 9, no. 1 (2019): 1-11.
30. Burton, Ross J., Mahableshwar Albur, Matthias Eberl, and Simone M. Cuff. „Using artificial intelligence to reduce diagnostic workload without compromising detection of urinary tract infections.“ BMC medical informatics and decision making 19, no. 1 (2019): 171.
31. Bonkat, G., R. Pickard, R. Bartoletti, F. Bruyere, S. E. Geerlings, and F. Wagenlehner. „Leitlinien zu urologischen Infektionen. EAU Guidelines.“ European Association of Urology (2017).
32. Jhang, Jia-Fong, and Hann-Chorng Kuo. „Jüngste Fortschritte bei rezidivierenden Harnwegsinfektionen von der Pathogenese und Biomarkern bis zur Prävention.“ Tzu-Chi Medical Journal 29, no. 3 (2017): 131.
33. Dason, Shawn, Jeyapandy T. Dason, und Anil Kapoor. „Leitlinien für die Diagnose und Behandlung von wiederkehrenden Harnwegsinfektionen bei Frauen.“ Canadian Urological Association Journal 5, no. 5 (2011): 316.
34. Karlsen, H., and T. Dong. „Biomarker für Harnwegsinfektionen: Stand der Technik und vielversprechende Anwendungen für schnelle chemische Sensoren auf Streifenbasis.“ Analytical Methods 7, no. 19 (2015): 7961-7975.
35. Mizutani, Kosuke, Kyojiro Kawakami, Kengo Horie, Yasunori Fujita, Koji Kameyama, Taku Kato, Keita Nakane et al. „Urinary exosome as a potential biomarker for urinary tract infection.“ Cellular microbiology 21, no. 7 (2019): e13020.
Related Content:
Download: Everyday Urology: Volume 5, Issue 1