Erdere Ideeën over Materie: Van Democritus tot Dalton
De moderne atoomtheorie

Priestley, Lavoisier en anderen hadden de basis gelegd voor het vakgebied van de chemie. Hun experimenten toonden aan dat sommige stoffen zich met andere konden verbinden tot nieuwe materialen, dat andere stoffen konden worden afgebroken tot eenvoudiger stoffen, en dat een paar belangrijke “elementen” niet verder konden worden afgebroken. Maar wat kon deze complexe reeks waarnemingen verklaren? John Dalton, een uitzonderlijke Britse leraar en wetenschapper, legde de puzzelstukjes bij elkaar en ontwikkelde in 1803 de eerste moderne atoomtheorie. Om meer te weten te komen over de experimenten van Priestley en Lavoisier en hoe deze de basis vormden voor de theorieën van Dalton, kunt u het interactieve experiment Dalton’s Playhouse proberen, waarnaar hieronder wordt gelinkt.
Dalton maakte er een vaste gewoonte van om het weer in zijn woonplaats Manchester, Engeland, bij te houden en te registreren. Door zijn observaties van ochtendmist en andere weerpatronen realiseerde Dalton zich dat water kon bestaan als een gas dat zich vermengde met lucht en dezelfde ruimte innam als lucht. Vaste stoffen kunnen niet dezelfde ruimte innemen als elkaar; ijs bijvoorbeeld kan zich niet vermengen met lucht. Hoe kon het dan gebeuren dat water zich soms als vaste stof en soms als gas gedroeg? Dalton realiseerde zich dat alle materie uit kleine deeltjes moet bestaan. In de gasstaat zweefden die deeltjes vrij rond en konden ze zich mengen met andere gassen, zoals Bernoulli had voorgesteld. Maar Dalton breidde dit idee uit tot alle materie – gassen, vaste stoffen en vloeistoffen. Dalton stelde voor het eerst een deel van zijn atoomtheorie voor in 1803 en verfijnde later deze concepten in zijn klassieke 1808 paper A New System of Chemical Philosophy (waartoe u toegang kunt krijgen via een link onder het tabblad Resources).
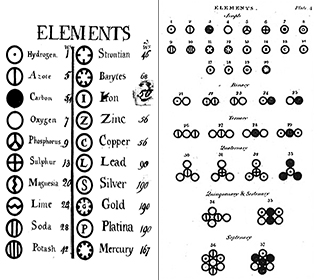
Dalton’s theorie had vier hoofdconcepten:
- Alle materie is opgebouwd uit ondeelbare deeltjes, atomen genaamd. Bernoulli, Dalton en anderen stelden zich atomen voor als kleine biljartbal-achtige deeltjes in verschillende bewegingstoestanden. Hoewel dit concept nuttig is om ons te helpen atomen te begrijpen, is het niet correct, zoals we zullen zien in latere modules over atoomtheorie waarnaar onderaan deze module wordt verwezen.
- Alle atomen van een bepaald element zijn identiek; atomen van verschillende elementen hebben verschillende eigenschappen. Dalton’s theorie stelde dat elk atoom van een element, zoals zuurstof, identiek is aan elk ander zuurstofatoom; verder zijn atomen van verschillende elementen, zoals zuurstof en kwik, verschillend van elkaar. Dalton karakteriseerde elementen aan de hand van hun atoomgewicht; toen echter eind 1800 isotopen van elementen werden ontdekt, veranderde dit concept.
-
Chemische reacties betreffen de combinatie van atomen, niet de vernietiging van atomen. Atomen zijn onverwoestbaar en onveranderlijk, zodat verbindingen, zoals water en kwikcalcium, worden gevormd wanneer een atoom zich chemisch met andere atomen verbindt. Dit was een zeer geavanceerd concept voor die tijd; hoewel Dalton’s theorie impliceerde dat atomen zich met elkaar verbonden, zou het meer dan 100 jaar duren voordat wetenschappers het concept van chemische binding begonnen uit te leggen.
-
Wanneer elementen reageren om verbindingen te vormen, reageren ze in gedefinieerde, gehele getallen verhoudingen. De experimenten die Dalton en anderen uitvoerden, toonden aan dat reacties geen willekeurige gebeurtenissen zijn; zij verlopen volgens nauwkeurige en welomschreven formules. Dit belangrijke concept in de scheikunde wordt hieronder nader besproken.
Comprehension Checkpoint
Een element bestaat uit
Enkele details van Dalton’s atoomtheorie vereisen meer uitleg.
Elementen: Al in 1660 zag Robert Boyle in dat de Griekse definitie van element (aarde, vuur, lucht en water) niet juist was. Boyle stelde een nieuwe definitie voor van een element als een fundamentele stof, en wij definiëren elementen nu als fundamentele stoffen die niet verder kunnen worden afgebroken met chemische middelen. Elementen zijn de bouwstenen van het universum. Het zijn zuivere stoffen die de basis vormen van alle materialen om ons heen. Sommige elementen kunnen in zuivere vorm worden waargenomen, zoals kwik in een thermometer; andere zien we vooral in chemische combinatie met andere, zoals zuurstof en waterstof in water. We kennen nu ongeveer 116 verschillende elementen. Elk van de elementen krijgt een naam en een afkorting van één of twee letters. Vaak is deze afkorting gewoon de eerste letter van het element; waterstof wordt bijvoorbeeld afgekort als H, en zuurstof als O. Soms krijgt een element een afkorting van twee letters; helium is bijvoorbeeld He. Bij het schrijven van de afkorting van een element wordt de eerste letter altijd met een hoofdletter geschreven en de tweede letter (als die er is) altijd met een kleine letter.
Atomen: Een enkele eenheid van een element wordt een atoom genoemd. Het atoom is de meest elementaire eenheid van materie, waaruit alles in de wereld om ons heen is opgebouwd. Elk atoom behoudt alle chemische en fysische eigenschappen van zijn moederelement. Aan het eind van de negentiende eeuw toonden wetenschappers aan dat atomen eigenlijk uit kleinere, “subatomaire” deeltjes bestonden, waarmee het biljartbalconcept van het atoom in duigen viel (zie onze module Atoomtheorie I: De beginperiode).
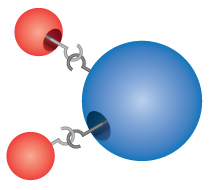
Compounds: De meeste materialen waarmee wij in aanraking komen zijn verbindingen, stoffen die worden gevormd door de chemische combinatie van twee of meer atomen van de elementen. Een enkel “deeltje” van een verbinding wordt een molecuul genoemd. Dalton stelde zich ten onrechte voor dat atomen aan elkaar “haakten” om moleculen te vormen. Dalton realiseerde zich echter wel dat verbindingen exacte formules hebben. Water, bijvoorbeeld, bestaat altijd uit twee delen waterstof en één deel zuurstof. De chemische formule van een verbinding wordt geschreven door de symbolen van de elementen bij elkaar te zetten, zonder spaties ertussen. Als een molecuul meer dan één atoom van een element bevat, wordt na het symbool een cijfer geschreven om het aantal atomen van dat element in het molecuul aan te geven. De formule voor water is dus H2O, nooit HO of H2O2.
Comprehension Checkpoint
The formula for water can be written as either H2O or HO2.