10.13: La hipótesis de Avogadro y el volumen molar
La hipótesis de Avogadro y el volumen molar
El volumen es una tercera forma de medir la cantidad de materia, después del recuento de elementos y la masa. En el caso de los líquidos y los sólidos, el volumen varía mucho en función de la densidad de la sustancia. Esto se debe a que las partículas sólidas y líquidas están muy juntas, con muy poco espacio entre ellas. Sin embargo, los gases se componen en gran medida de espacios vacíos entre las propias partículas de gas (véase la figura siguiente).
En 1811, Amadeo Avogadro explicó que los volúmenes de todos los gases pueden determinarse fácilmente. La hipótesis de Avogadro afirma que volúmenes iguales de todos los gases a la misma temperatura y presión contienen igual número de partículas. Dado que el volumen total que ocupa un gas está formado principalmente por el espacio vacío entre las partículas, el tamaño real de las propias partículas es casi insignificante. Un volumen determinado de un gas con pequeñas partículas ligeras, como el hidrógeno (izquierda) contiene el mismo número de partículas que el mismo volumen de un gas pesado con partículas grandes, como el hexafluoruro de azufre. Esto disminuye la cantidad de espacio vacío y reduce el volumen del gas. El volumen del gas también se ve afectado por la temperatura. Cuando un gas se calienta, sus moléculas se mueven más rápido y el gas se expande. Debido a la variación del volumen de los gases debido a los cambios de presión y temperatura, la comparación de los volúmenes de los gases debe hacerse a una temperatura y presión estándar. La temperatura y la presión estándar (STP) se definen como \(0^\text{o} \text{C}\) \(\left( 273,15 \text{K} \right)\) y \(1 \text{atm}\) presión. El volumen molar de un gas es el volumen de un mol de un gas a STP. A STP, un mol (\( 6,02 \times 10^{23}\) partículas representativas) de cualquier gas ocupa un volumen de \(22,4 \: \text{L}\) (figura siguiente).

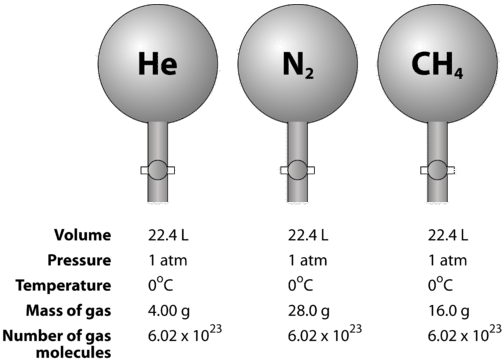
La siguiente figura ilustra cómo puede verse el volumen molar al comparar diferentes gases. Las muestras de helio (izquierda), de nitrógeno (izquierda) y de metano (izquierda) están a STP. Cada uno de ellos contiene 1 mol o \N(6,02 \Nveces 10^{23}\) de partículas. Sin embargo, la masa de cada gas es diferente y corresponde a la masa molar de ese gas: \ (4,00 \: \text{g/mol}\) para \(\ce{He}\), \ (28,0 \: \text{g/mol}\) para \(\ce{N_2}\), y \ (16,0 \text{g/mol}\) para \(\ce{CH_4}\).