19.1: Polypeptides and Proteins
Learning Objectives
- Define or describe the following:
- amino acid
- «R» group
- peptide bond
- peptide
- polypeptide
- primary protein structure
- secondary protein structure
- tertiary protein structure
- quaternary protein structure
- gene
- Describe how the primary structure of a protein or polypeptide ultimately detemines its final three-dimensional shape.
- Describe how the order of nucleotide bases in DNA ultimately determines the final three-dimensional shape of a protein or polypeptide.
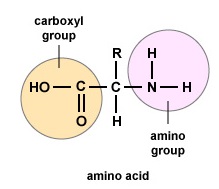
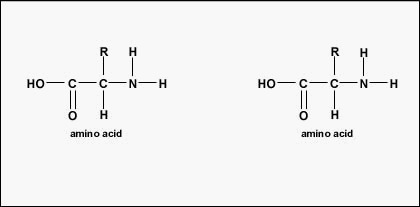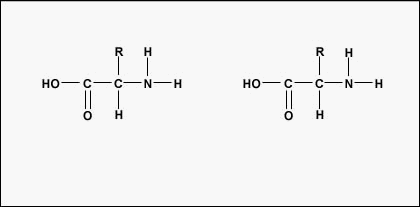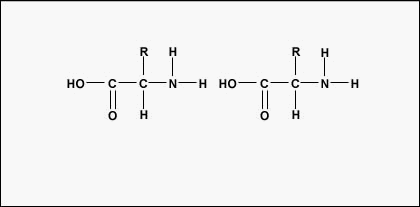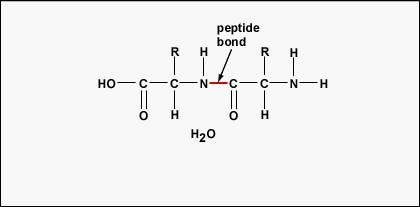
Amino acids are the building blocks for proteins. All amino acids contain an amino or NH2 group and a carboxyl (acid) or COOH group. There are 20 different amino acids commonly found in proteins and often 300 or more amino acids per protein molecule. Cada aminoácido se diferencia por su grupo «R». El grupo «R» de un aminoácido es el resto de la molécula, es decir, la parte que no es el grupo amino, el grupo ácido y el carbono central. Cada aminoácido diferente tiene un grupo «R» único y las propiedades químicas únicas de un aminoácido dependen de las de su grupo «R» (Figura (\PageIndex{1})).
Para formar polipéptidos y proteínas, los aminoácidos se unen entre sí mediante enlaces peptídicos, en los que el amino o NH2 de un aminoácido se une al grupo carboxilo (ácido) o COOH de otro aminoácido, tal y como se muestra en (Figura (\PageIndex{2}) y Figura (\PageIndex{3})).
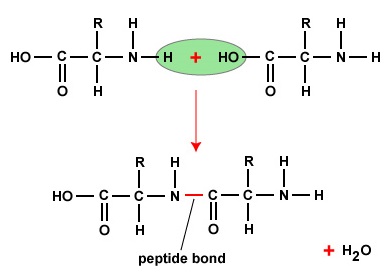
Un péptido son dos o más aminoácidos unidos por enlaces peptídicos, y un polipéptido es una cadena de muchos aminoácidos. Una proteína contiene uno o más polipéptidos. Por lo tanto, las proteínas son largas cadenas de aminoácidos unidas por enlaces peptídicos.
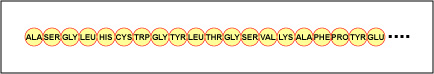
El orden real de los aminoácidos en la proteína se llama su estructura primaria (Figura \(\PageIndex{4}\)) y está determinado por el ADN. Como se verá más adelante en esta unidad, el ADN se divide en unidades funcionales llamadas genes. Un gen es una secuencia de bases desoxirribonucleotídicas a lo largo de una cadena de ADN que codifica un producto funcional: una molécula específica de ARN mensajero, ARN de transferencia o ARN ribosómico. El producto suele ser ARN mensajero (ARNm) y el ARNm acaba dando lugar a la síntesis de un polipéptido o una proteína. Por lo tanto, se suele decir que el orden de las bases desoxirribonucleotídicas en un gen determina la secuencia de aminoácidos de una proteína concreta. Dado que ciertos aminoácidos pueden interactuar con otros aminoácidos en la misma proteína, esta estructura primaria determina en última instancia la forma final y, por tanto, las propiedades químicas y físicas de la proteína.
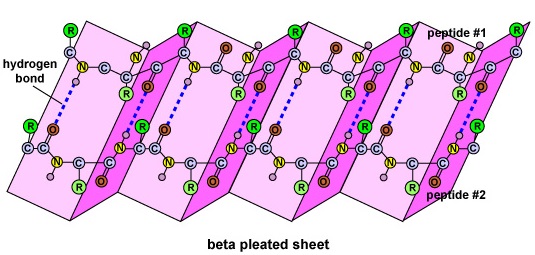
La estructura secundaria de la proteína se debe a los enlaces de hidrógeno que se forman entre el átomo de oxígeno de un aminoácido y el átomo de nitrógeno de otro. Esto da a la proteína o al polipéptido la forma bidimensional de una hélice alfa o de una lámina plegada beta (Figura \(\PageIndex{5}\)).
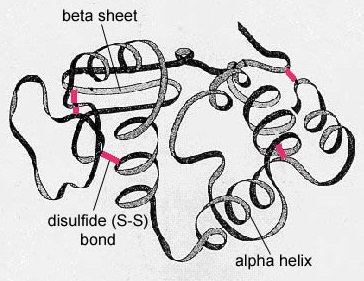
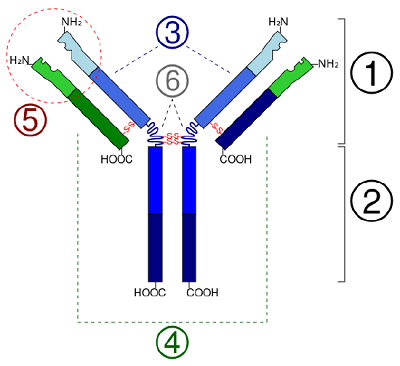
En las proteínas globulares, como las enzimas, la larga cadena de aminoácidos se pliega en una forma funcional tridimensional o estructura terciaria. Esto se debe a que ciertos aminoácidos con grupos sulfhidrilos o SH forman enlaces disulfuro (S-S) con otros aminoácidos de la misma cadena. Otras interacciones entre los grupos R de los aminoácidos, como los enlaces de hidrógeno, los enlaces iónicos, los enlaces covalentes y las interacciones hidrofóbicas, también contribuyen a la estructura terciaria (Figura \(\PageIndex{6}\)). En algunas proteínas, como las moléculas de anticuerpos y la hemoglobina, varios polipéptidos pueden unirse para formar una estructura cuaternaria (Figura \(\PageIndex{7})).
Como se verá más adelante en esta unidad, durante la síntesis de proteínas, el orden de las bases de los nucleótidos a lo largo de un gen se transcribe en una cadena complementaria de ARNm que luego es traducida por el ARNt en el orden correcto de los aminoácidos para ese polipéptido o proteína. Por lo tanto, el orden de las bases desoxirribonucleótidas a lo largo del ADN determina el orden de los aminoácidos en las proteínas. Como ciertos aminoácidos pueden interactuar con otros aminoácidos, el orden de los aminoácidos de cada proteína determina su forma tridimensional final, que a su vez determina la función de esa proteína (por ejemplo con qué sustrato reaccionará una enzima, con qué epítopos se combinará el Fab de un anticuerpo, a qué receptores se unirá una citoquina).
Resumen
- Los aminoácidos son los componentes básicos de las proteínas. Hay 20 aminoácidos diferentes que se encuentran comúnmente en las proteínas y a menudo 300 o más aminoácidos por molécula de proteína.
- Todos los aminoácidos contienen un grupo amino o NH2 y un grupo carboxilo (ácido) o COOH.
- Para formar polipéptidos y proteínas, los aminoácidos se unen mediante enlaces peptídicos, en los que el amino o NH2 de un aminoácido se une al grupo carboxilo (ácido) o COOH de otro aminoácido.
- Un péptido son dos o más aminoácidos unidos por enlaces peptídicos; un polipéptido es una cadena de muchos aminoácidos; y una proteína contiene uno o más polipéptidos. Por lo tanto, las proteínas son largas cadenas de aminoácidos unidas por enlaces peptídicos.
- El orden real de los aminoácidos en la proteína se denomina estructura primaria y está determinado por el ADN.
- El orden de las bases desoxirribonucleótidas en un gen determina la secuencia de aminoácidos de una proteína concreta. Dado que ciertos aminoácidos pueden interactuar con otros aminoácidos en la misma proteína, esta estructura primaria determina en última instancia la forma final y, por tanto, las propiedades químicas y físicas de la proteína.
- La estructura secundaria de la proteína se debe a los enlaces de hidrógeno que se forman entre el átomo de oxígeno de un aminoácido y el átomo de nitrógeno de otro y da a la proteína o al polipéptido la forma bidimensional de una hélice alfa o una lámina plegada beta.
- En las proteínas globulares, como las enzimas, la larga cadena de aminoácidos se pliega en una forma funcional tridimensional o estructura terciaria. Esto se debe a que ciertos aminoácidos con grupos sulfhidrilo o SH forman enlaces disulfuro (S-S) con otros aminoácidos de la misma cadena. Otras interacciones entre los grupos R de los aminoácidos, como los enlaces de hidrógeno, los enlaces iónicos, los enlaces covalentes y las interacciones hidrofóbicas, también contribuyen a la estructura terciaria.
- In some proteins, such as antibody molecules, several polypeptides may bond together to form a quaternary structure.
Contributors and Attributions
-
Dr. Gary Kaiser (COMMUNITY COLLEGE OF BALTIMORE COUNTY, CATONSVILLE CAMPUS)