4. Bases fuertes y débiles
Bases débiles
El amoníaco es una típica base débil. Obviamente, el amoníaco en sí mismo no contiene iones de hidróxido, pero reacciona con el agua para producir iones de amonio e iones de hidróxido.
Sin embargo, la reacción es reversible, y en cualquier momento alrededor del 99% del amoníaco sigue presente como moléculas de amoníaco. Sólo un 1% ha producido iones de hidróxido. Una base débil es aquella que no se convierte completamente en iones de hidróxido en solución. Cuando una base débil reacciona con el agua, la posición de equilibrio varía de una base a otra. Cuanto más a la izquierda esté, más débil será la base.
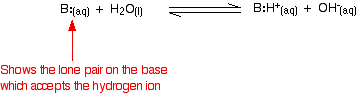
Puedes obtener una medida de la posición de un equilibrio escribiendo una constante de equilibrio para la reacción. Cuanto más bajo sea el valor de la constante, más a la izquierda estará el equilibrio. En este caso, la constante de equilibrio se llama Kb. Se define como:
\}{}\]
The relationship between Kb and pKb is exactly the same as all the other «p» terms in this topic:
\
The table shows some values for \(K_b\) and \(pK_b\) for some weak bases.
| base | Kb (mol dm-3) | pKb |
|---|---|---|
| C6H5NH2 | 4.17 x 10-10 | 9.38 |
| NH3 | 1.78 x 10-5 | 4.75 |
| CH3NH2 | 4.37 x 10-4 | 3.36 |
| CH3CH2NH2 | 5.37 x 10-4 | 3.27 |