Adipocitos
Los adipocitos son los principales sitios de almacenamiento de energía en el cuerpo, y también tienen funciones endocrinas críticas. Por lo tanto, comprender el desarrollo y la función de los adipocitos -especialmente a la luz de la pandemia de obesidad- es esencial para entender la homeostasis metabólica. Existen dos clases generales de adipocitos: los adipocitos blancos, que almacenan energía en forma de una sola gota lipídica de gran tamaño y tienen importantes funciones endocrinas, y los adipocitos marrones, que almacenan energía en múltiples gotas lipídicas pequeñas, pero específicamente para su uso como combustible para generar calor corporal (es decir, termogénesis). La producción de calor por parte de los adipocitos marrones es posible gracias a su expresión única de la proteína de desacoplamiento localizada en las mitocondrias 1 (Ucp1). Sin embargo, estas clasificaciones están demasiado simplificadas porque algunos adipocitos blancos pueden adoptar características de adipocitos marrones (denominados adipocitos brite o beige) y viceversa, dependiendo de la temperatura y la dieta. Estamos interesados en comprender los orígenes de los diferentes adipocitos y en definir las vías de señalización y metabólicas que controlan su desarrollo, distribución y función.
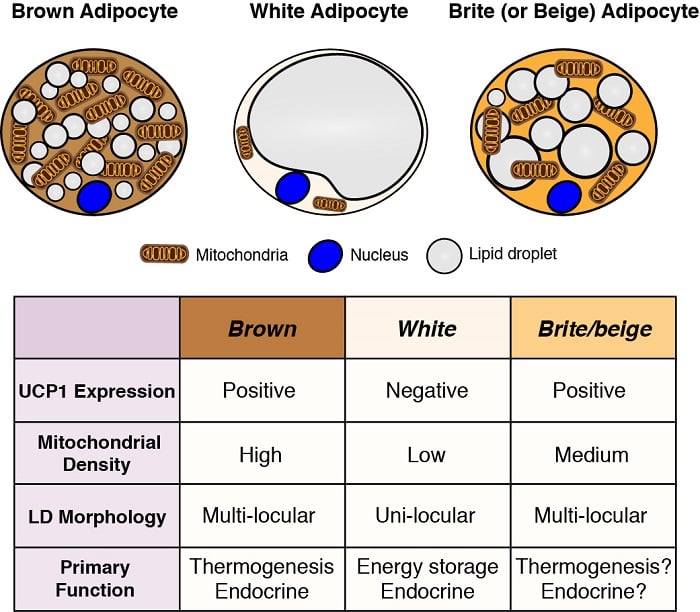
Orígenes de los adipocitos
Para entender el papel del tejido adiposo en la salud y la enfermedad es fundamental comprender cómo crece y, en este sentido, una de las áreas menos conocidas de la biología del tejido adiposo es el origen del desarrollo de los diferentes tipos de adipocitos. Definir el origen de los adipocitos podría ayudar a explicar los patrones de distribución de la grasa corporal en el ser humano, sobre todo en individuos obesos o lipodistróficos, y podría aportar pistas sobre las diferencias metabólicas observadas entre algunos depósitos de grasa. Identificar las células precursoras de los adipocitos y los mecanismos que regulan su expansión también es fundamental para comprender y gestionar la función del tejido adiposo sano. También puede ser posible diseñar el desarrollo de adipocitos «sanos» (como los adipocitos marrones o de color marrón/beige) a partir de precursores para terapias celulares destinadas esencialmente a combatir la grasa con grasa. Mediante una combinación de estrategias genéticas y de rastreo de linajes, hemos mapeado previamente los orígenes de los adipocitos que residen en diferentes depósitos. Nuestros resultados revelan un nivel inesperado de heterogeneidad consistente con que los adipocitos tienen múltiples orígenes de desarrollo y apoyan un modelo en el que el destino de los adipocitos probablemente depende de factores tanto extrínsecos como intrínsecos.
Los adipocitos tienen múltiples orígenes de desarrollo
(abajo a la izquierda) Distribución anatómica de los depósitos de tejido adiposo en un ratón. Se muestran los depósitos de tejido adiposo marrón (BAT) y de tejido adiposo blanco (WAT). (Abajo a la derecha) Un ejemplo de un experimento de rastreo de linaje durante el cual las células precursoras del desarrollo y todos sus descendientes fueron marcados indeleblemente con una marca fluorescente vinculada a la expresión de Myf5 (panel a) o Pax3 (panel b). Los adipocitos etiquetados en verde (mGFP) se originan a partir de una célula precursora diferente que los adipocitos etiquetados en rojo (mTFP).
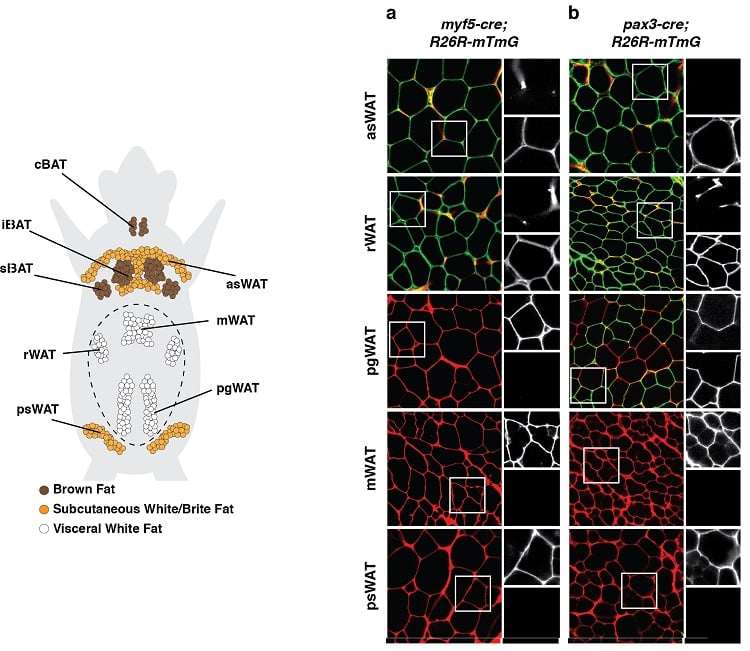
Resultados como estos sugieren que los adipocitos tienen múltiples orígenes de desarrollo.
(adaptado de Sánchez-Gurmaches & Guertin, Nature Communications 2014; Sánchez-Gurmaches et al., Trends in Cell Biology 2016).
Adipocitos marrones
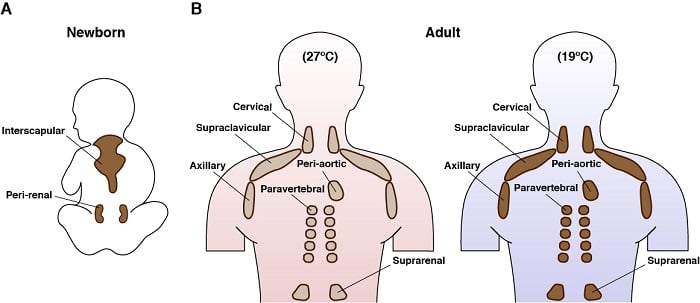
Los adipocitos marrones son células fascinantes. Solo existen en los mamíferos, y su función principal es generar calor endógeno en un proceso llamado termogénesis. Esto es posible gracias a su expresión única de una proteína de membrana mitocondrial llamada proteína de desacoplamiento 1 (UCP1). Las propiedades de gasto energético de la grasa parda, y la reciente constatación de que los humanos adultos tienen grasa parda, la han convertido en un objetivo para las terapias destinadas a combatir la sobrealimentación. Los adipocitos marrones activos también tienen uno de los programas metabólicos más intrigantes: toman y consumen grandes cantidades de diversos nutrientes simultáneamente (por ejemplo, glucosa, lípidos, aminoácidos) y pueden participar simultáneamente en el metabolismo anabólico y catabólico. Por ejemplo, nosotros y otros demostramos anteriormente que las MTD estimuladas por el frío regulan ampliamente un programa genético que apoya las vías de síntesis de lípidos de novo, además de las vías de oxidación de ácidos grasos. Nos gustaría entender más sobre este notable y paradójico metabolismo.
Aprenda más sobre el desarrollo y el metabolismo del tejido adiposo marrón
Localización anatómica de la grasa marrón en los seres humanos
También utilizamos modelos genéticos para investigar cómo las vías de señalización controlan el metabolismo del BAT. Por ejemplo, utilizando ratones eliminamos genéticamente Rictor -que codifica un componente único y esencial de mTORC2- sólo en el tejido adiposo marrón. Más información sobre mTORC2. Sorprendentemente, estos ratones están protegidos de una dieta alta en grasas. Más concretamente, los ratones que carecen de BAT Rictor no acumularon un exceso de lípidos en el hígado o en los depósitos de tejido adiposo visceral cuando siguieron una dieta alta en grasas. Se trata de un hallazgo muy interesante, ya que el almacenamiento excesivo de lípidos en estos lugares es peligrosamente insalubre. Utilizando una combinación de genética, genómica, metabolómica y bioquímica, estamos tratando de entender por qué estos ratones están protegidos de la dieta alta en grasas.
Adipocitos blancos
Los adipocitos blancos son los más abundantes en los seres humanos. Los depósitos de tejido adiposo blanco también tienen una notable capacidad para expandirse y almacenar energía, y envían señales al cerebro y a otros tejidos para influir fuertemente en el comportamiento alimentario y la homeostasis metabólica. Sin embargo, aunque los adipocitos blancos están específicamente adaptados para almacenar de forma segura el exceso de nutrientes, tienen un punto de inflexión (por ejemplo, en la obesidad) en el que sus funciones beneficiosas fallan, lo que favorece en gran medida la aparición de enfermedades metabólicas y diabetes de tipo 2. ¿Qué define el punto de inflexión? ¿Cómo señalan los adipocitos blancos a otros tejidos? ¿Hasta qué punto son heterogéneos los depósitos de tejido adiposo blanco? ¿Por qué el exceso de grasa visceral es más perjudicial para la salud que el exceso de grasa subcutánea? Todas estas son preguntas pendientes que nos interesan.
También estamos estudiando la señalización de mTOR en los adipocitos blancos. mTOR es una importante diana descendente de la señalización de la insulina, que es la principal hormona a la que responden los adipocitos. Utilizando modelos genéticos de ratón, inhibimos selectivamente mTORC1 o mTORC2 en todos los adipocitos. La inhibición de mTORC1 en el tejido adiposo blanco provoca un síndrome similar a la lipodistrofia, asociado a la resistencia a la insulina y a la enfermedad del hígado graso. La inhibición de mTORC2 en el tejido adiposo blanco también provoca resistencia a la insulina, pero independientemente de los cambios en la masa del tejido adiposo. En este último modelo, mTORC2 parece regular una señal derivada de los adipocitos que se comunica con el hígado para controlar la producción hepática de glucosa. Entender la base mecanística de estos fenotipos proporcionará información crítica sobre cómo las vías de transducción de señales de detección de nutrientes contribuyen a la patogénesis de las enfermedades relacionadas con el tejido adiposo.
Modelo de señalización de mTORC2 en un adipocito blanco
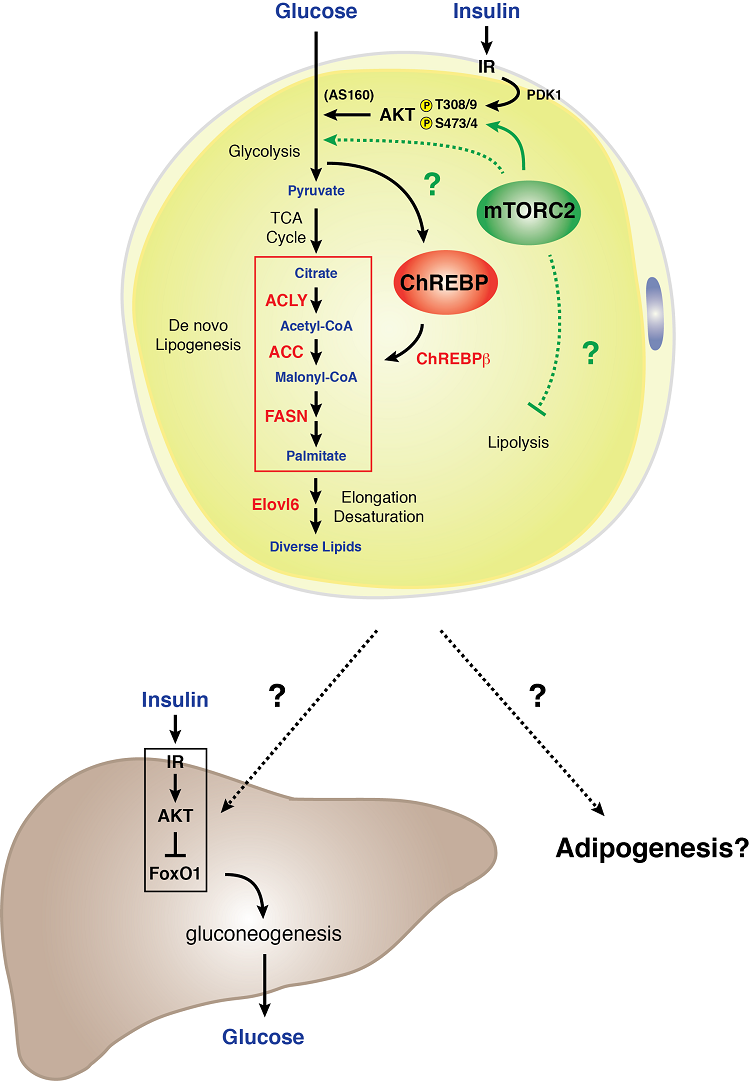 Los adipocitos blancos requieren mTORC2 para el metabolismo normal de los carbohidratos y los lípidos. Descubrimos que la pérdida genética de Rictor (mTORC2) específicamente en los adipocitos blancos reduce la captación de glucosa y atenúa la expresión del factor de transcripción ChREBP-beta y sus objetivos descendentes, que incluyen las enzimas que funcionan en la vía de la lipogénesis de novo. Además, una deficiencia de mTORC2 en los adipocitos blancos provoca una grave resistencia hepática a la insulina. Estos datos indican que el mTORC2 de los adipocitos blancos es un regulador esencial del metabolismo de los hidratos de carbono y de los lípidos y es un componente clave de un mecanismo de comunicación de órganos sensores de nutrientes extrahepáticos que controla la homeostasis sistémica de la glucosa . La comprensión de la biología de la señalización de mTORC2 en la grasa blanca puede contener pistas importantes sobre cómo el tejido adiposo blanco funciona como un órgano sensor de la glucosa y mediador de la aptitud metabólica sistémica.
Los adipocitos blancos requieren mTORC2 para el metabolismo normal de los carbohidratos y los lípidos. Descubrimos que la pérdida genética de Rictor (mTORC2) específicamente en los adipocitos blancos reduce la captación de glucosa y atenúa la expresión del factor de transcripción ChREBP-beta y sus objetivos descendentes, que incluyen las enzimas que funcionan en la vía de la lipogénesis de novo. Además, una deficiencia de mTORC2 en los adipocitos blancos provoca una grave resistencia hepática a la insulina. Estos datos indican que el mTORC2 de los adipocitos blancos es un regulador esencial del metabolismo de los hidratos de carbono y de los lípidos y es un componente clave de un mecanismo de comunicación de órganos sensores de nutrientes extrahepáticos que controla la homeostasis sistémica de la glucosa . La comprensión de la biología de la señalización de mTORC2 en la grasa blanca puede contener pistas importantes sobre cómo el tejido adiposo blanco funciona como un órgano sensor de la glucosa y mediador de la aptitud metabólica sistémica.