Aplicando la geociencia a los retos más importantes de Australia
Introducción

Papel de aluminio. Fuente: Wikimedia Commons
El aluminio está a tu alrededor: desde objetos cotidianos como una lata de refresco hasta los aviones que te sobrevuelan. El aluminio es uno de los materiales más útiles conocidos por el hombre. Se puede alear (mezclar) con casi cualquier otro metal para crear materiales con propiedades útiles. Los metales aleados con aluminio son todos muy fuertes, aunque ligeros, y resistentes a la oxidación.
Después del oxígeno y el silicio, el aluminio es el tercer elemento más abundante en la corteza terrestre (8,2%) y el metal más abundante con diferencia. A diferencia de metales como el cobre, el oro, el plomo, el hierro y el zinc, que han sido utilizados por el ser humano durante miles de años, el aluminio sólo ha sido de uso común durante poco más de 100 años. Esto se debe a que el aluminio nunca se encuentra en estado puro en la naturaleza. Así que, aunque los humanos conocían los compuestos de aluminio, no descubrieron cómo extraer el metal de aluminio hasta finales del siglo XIX.
El aluminio puede extraerse (de forma poco económica) de algunas arcillas, pero el mineral de aluminio más común es un material llamado bauxita. Primero hay que extraer el mineral de aluminio y luego refinar la bauxita para convertirla en alúmina (óxido de aluminio). Se utilizan grandes cantidades de electricidad para fundir la alúmina y convertirla en aluminio metálico.
Propiedades
El aluminio es un metal de color plateado que nunca se encuentra solo en la naturaleza. Es muy ligero (aproximadamente un tercio del peso del cobre) y a la vez fuerte; algunas aleaciones son incluso más fuertes que el acero. El aluminio es maleable (se puede prensar para darle forma) y dúctil (se puede batir y estirar en forma de alambre). El aluminio es un buen conductor térmico y eléctrico. También es muy resistente a la oxidación y no es tóxico. El aluminio puede alearse con casi cualquier otro metal. El aluminio es inflamable, no magnético y no produce chispas. These properties have made it an important metal in the modern world. As aluminium is such a reactive metal, you might think it would rust badly and therefore be useless. However, pure aluminium reacts very quickly with air or water to form a thin, almost invisible layer of aluminium oxide on its surface, which then acts as a protective coating preventing any further ‘rusting’.
|
The Properties of Aluminium |
|
|---|---|
|
Chemical symbol |
Al – from the Roman word Alumen – the word for the aluminium-potassium compound alum |
|
Ore |
Bauxite |
|
Relative density |
2.7 g/cm3 |
|
Hardness |
2.75 on Mohs scale |
|
Malleability |
High |
|
Ductility |
High |
|
Melting point |
660°C |
|
Boiling Point |
2470°C |
Uses

Aluminium-bodied Austin «A40 Sports» (c. 1951). Fuente: Wikimedia Commons
Aluminium is smelted from alumina which is refined from bauxite ore. All three products have a number of uses.
More than 90% of the world’s bauxite production is used to make alumina with most of the remaining 10% used by the abrasive, refractory and chemical industries. Bauxite is also used in the production of high-alumina cement, as an absorbent or catalyst by the oil industry, in welding rod coatings and as a flux in making steel and ferroalloys.
Alumina’s primary use is as feedstock for aluminium smelters, however it is also used for other industrial purposes. It is used in glass, porcelain and in metallic paints, such as those sprayed on cars. También se utiliza en la producción de aislantes para bujías, como componente de combustible para cohetes de propulsión sólida, como relleno para plásticos, como abrasivo (es más barato que el diamante industrial) y en las refinerías de metales, donde se utiliza para convertir los gases residuales tóxicos de sulfuro de hidrógeno en azufre elemental.
La alúmina que se encuentra en estado natural y cristalino se conoce como el mineral corindón. A veces, los cristales de corindón están contaminados con trazas de cromo, hierro, titanio, cobre o magnesio. A estos cristales los llamamos rubíes y zafiros.
Después del hierro y el acero, el aluminio es el metal más utilizado en la Tierra. A menudo se alea con cobre, zinc, magnesio, manganeso o silicio y la adición de pequeñas cantidades de circonio, hafnio o escandio a estas aleaciones mejora notablemente su resistencia. El aluminio en sí tiene una amplia gama de usos, desde la construcción de aviones especializados hasta artículos cotidianos como cuchillos y tenedores. En la siguiente tabla se enumeran algunos de sus usos.
|
Use |
Description |
|---|---|
|
Building and construction |
Cladding, doors, window frames, awnings and bridge rails as aluminium is strong, light, easily shaped and resistant to rust. |
|
Transport |
Parts for cars, trucks, buses, aircraft, ships, rail and trams as aluminium is strong, light, easily shaped and resistant to rust. |
|
Appliances |
Fridges, washing machines, lawn mowers etc. due to its strength, malleability and rust resistance. |
|
Heating and ventilation |
Heating and cooling systems as aluminium is a good conductor of heat. |
|
Packaging |
Kitchen foil, packaging foil, cans and containers (worldwide, four out of every five drink cans are made of aluminium) as aluminium can be rolled into very thin sheets and is non-toxic. |
|
Electrical and communications |
Power transmission including towers, electrical conduits, superconductors, machinery and equipment, telephone cables and capacitors because of aluminium’s ability to conduct electricity. |
|
Other |
Utensils (cutlery, pans), industrial machinery, chemical industry, production of steel, antiperspirants, furniture, reflectors in telescopes, making high octane petrol, road signs, antacids and jewellery due to its many useful properties. |
History
Around 5300 BC: The Persians made extra strong pots from clay containing aluminium oxide.
Around 2000 BC: The ancient Egyptians and Babylonians used potassium aluminium sulphate KAl(SO4)2 as a medicine to reduce bleeding. It was sourced from naturally occurring deposits in Greece and Turkey. The ancient Romans called this medical compound «alum», which is where we get the modern day word and symbol from. Todavía se utiliza hoy en día para detener las hemorragias.
Medioevo: La mayor parte del alumbre procedía del territorio papal de Tolfa, pero el precio bajó drásticamente cuando se descubrió un gran yacimiento de pizarra de alumbre en Yorkshire a principios del siglo XVII. Durante los siglos siguientes, el alumbre se utilizó en dos ámbitos principales: como conservante del papel y como agente fijador para teñir telas.
1808: El inglés Sir Humphry Davy intentó extraer aluminio mediante electrólisis. Fracasó, pero estableció su existencia y le dio su nombre.
1821: el geólogo francés Pierre Berthier descubrió un material rico en aluminio cerca del pueblo de Les Baux en la Provenza, Francia. Recibió el nombre de bauxita en honor al pueblo.
1825: Hans Christian Oersted, en Dinamarca, produjo aluminio impuro calentando cloruro de aluminio con amalgama de potasio.
1827: El químico alemán Friedrich Wöhler extrajo aluminio en forma de polvo haciendo reaccionar potasio con cloruro de aluminio anhidro mejorando el proceso de Oersted.
1855: El químico francés Henri Saint-Claire Deville logró obtener una barra sólida de aluminio utilizando sodio en lugar del más caro potasio. La barra de aluminio se consideró tan preciosa que se expuso ese mismo año junto a las joyas de la corona francesa.
1886: Dos científicos de continentes distintos (Charles Hall en América y Paul Heroult en Francia) descubrieron de forma independiente un método económico para producir aluminio mediante electrólisis en criolita fundida (fluoruro de aluminio y sodio). Por cierto, ambos nacieron en 1864 y murieron en 1914.
1887: El químico austriaco Karl Josef Bayer, que trabajaba en Rusia, desarrolló un método para extraer alúmina de la bauxita.
1888: Hall funda la Pittsburgh Reduction Company (conocida como Alcoa desde 1907).
1890: Los descubrimientos de Hall-Heroult y Bayer habían hecho que el precio del aluminio se desplomara un 80%. En 1888, el aluminio costaba 4,86 dólares la libra. En 1893, costaba 0,78 dólares la libra y a finales de la década de 1930 costaba sólo 0,20 dólares la libra y tenía más de 2000 usos.
1900: Sólo se produjeron 8000 toneladas de aluminio, pero 100 años después se produjeron 24,5 millones de toneladas y en 2016 se estima que se produjeron 57,6 millones de toneladas.

El avión de combate F-16 fue diseñado para ser relativamente barato de construir y más sencillo de mantener que los cazas de la generación anterior. El fuselaje está construido con un 80% de aleaciones de aluminio de calidad aeronáutica, un 8% de acero, un 3% de materiales compuestos y un 1,5% de titanio. Fuente: Wikimedia Commons, Master Sgt. Andy Dunaway
1911: El químico alemán Alfred Wilm desarrolló importantes aleaciones de aluminio lo suficientemente sólidas para la fabricación de artículos como los aviones. Hubo una gran demanda de aluminio durante la Segunda Guerra Mundial y la Guerra de Corea, ya que antes los aviones se fabricaban con madera y tela.
1922: Se fabricó papel de aluminio.
1955: Se inaugura la primera fundición de aluminio de Australia en Bell Bay, Tasmania.
1958: Se producen por primera vez latas de aluminio para refrescos.
1961: Alcoa crea Alcoa de Australia.
1963: Alcoa de Australia abre la primera refinería de alúmina en Australia en Kwinana en Australia Occidental, seguida por Pinjarra en 1972 y Wagerup en 1984.
Hoy en día: En 2016 se estima que se produjeron 57,6 millones de toneladas de aluminio. Esto es más que todos los demás metales no ferrosos juntos. Australia extrae bauxita en Queensland, Australia Occidental, el Territorio del Norte y Tasmania y es el mayor productor de bauxita del mundo. Australia también es líder mundial en la producción de alúmina y aluminio. Las tres refinerías de Australia Occidental suministran el 45% de la alúmina de Australia y el 11% del total mundial, lo que las convierte en la mayor fuente de alúmina del mundo.
Formación

Bauxita de Weipa, R30128. Fuente: Geoscience Australia.
La bauxita es el mineral de aluminio más común. La bauxita se presenta como una cubierta o manto meteorizado, conocido como laterita o duricrust, sobre una variedad de rocas que contienen alúmina. Se forma cuando grandes cantidades de lluvia lixivian los elementos más móviles de la roca huésped dejando el aluminio relativamente inmóvil con algo de silicio, hierro y titanio. Debido a su formación, los yacimientos de bauxita pueden ser muy extensos y se encuentran en casi todos los continentes.
Los principales minerales de aluminio de la bauxita son la gibbsita, la boehmita y el diásporo, que es un polimorfo (forma alternativa) de la boehmita pero más denso y duro. La alúmina pura (Al2O3) contiene un 52,9% de aluminio y un 47,1% de oxígeno. La bauxita puede ser muy dura o tan blanda como el lodo y puede presentarse como tierra compactada (tanto friable como recementada), pequeñas bolas (pisolitas) o material hueco en forma de ramita (túbulos). Sus colores pueden ser beige, rosa, amarillo, rojo o blanco, o cualquier combinación de ellos. El aluminio también está presente en muchas piedras preciosas como la turquesa, los rubíes, los zafiros, las esmeraldas, el topacio, el jade y las aguamarinas.
Recursos
El mineral de bauxita contiene niveles suficientemente altos de óxidos de aluminio y niveles convenientemente bajos de óxido de hierro (Fe2O3) y sílice (SiO2) como para ser económicamente explotable. La cantidad de sílice reactiva es especialmente importante, ya que esta forma de sílice consume la sosa cáustica necesaria para fabricar alúmina, por lo que es deseable un nivel bajo de sílice reactiva. Otras fuentes potenciales de aluminio incluyen una variedad de rocas y minerales como el esquisto y la pizarra aluminosos, la roca de fosfato de aluminio y las arcillas con alto contenido de alúmina.
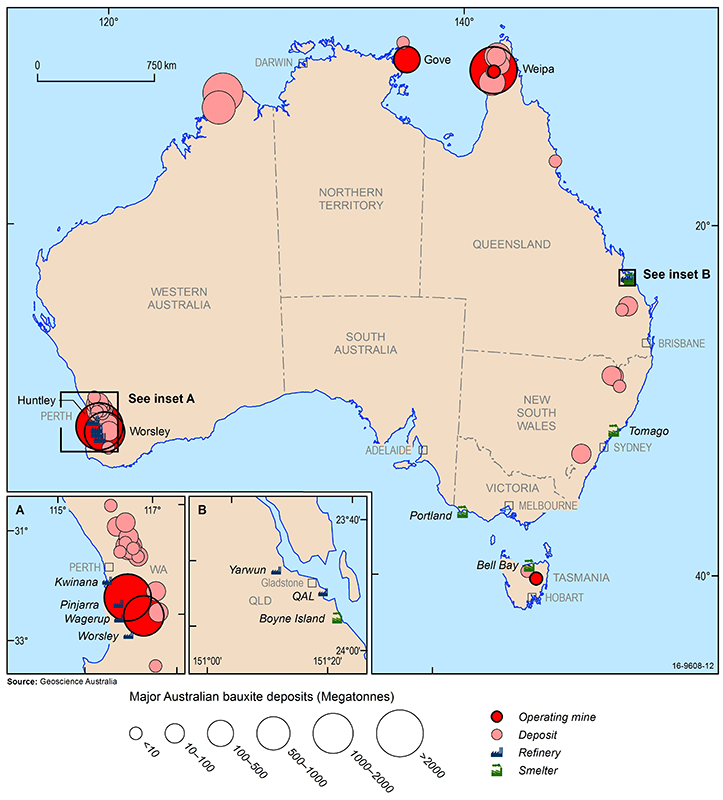
Los principales depósitos de bauxita, minas, refinerías de alúmina y fundiciones de aluminio de Australia (2016). Source: Geoscience Australia.
Los mayores recursos económicos de bauxita del mundo se encuentran en Guinea, Australia, Brasil, Vietnam y Jamaica. En Australia, la bauxita se extrae de operaciones establecidas a cielo abierto en Weipa en Queensland, Gove en el Territorio del Norte y Darling Range en Australia Occidental. Además, recientemente se han puesto en marcha nuevas minas en la región de Cape York en Queensland y en el centro de Tasmania. Hay otros yacimientos de bauxita en el norte de Australia Occidental, en Nueva Gales del Sur y en el este de Queensland, pero en la actualidad su explotación no es rentable.
Las refinerías de alúmina de Australia están situadas en Australia Occidental (Kwinana, Wagerup, Pinjarra y Worsely) y en Queensland (QAL y Yarwun) y sus fundiciones de aluminio se encuentran en Tasmania (Bell Bay), Queensland (Boyne Island), Victoria (Portland) y Nueva Gales del Sur (Tomago). China es el mayor consumidor mundial de aluminio y, a pesar de la fuerte producción nacional, importa grandes cantidades de alúmina y bauxita en bruto, lo que supone más del 40% del consumo mundial. Otros grandes mercados de aluminio son los Estados Unidos de América, Japón y Europa, pero estas regiones poseen pocos yacimientos económicos de bauxita y también dependen de las importaciones de bauxita y alúmina para sus refinerías de alúmina y fundiciones de aluminio.
Más información sobre los recursos y la producción.
Minería
La extracción del aluminio metálico se realiza en tres etapas principales: la extracción del mineral de bauxita, el refinado del mineral para recuperar la alúmina y la fundición de la alúmina para producir aluminio. La bauxita se extrae mediante métodos de superficie (minería a cielo abierto) en los que la capa superior del suelo y la sobrecarga se eliminan con excavadoras y rascadores. La tierra vegetal se almacena y se utiliza posteriormente para revegetar y restaurar la zona una vez finalizada la explotación. La bauxita subyacente se extrae con cargadores frontales, palas mecánicas o excavadoras hidráulicas. Algunos minerales de bauxita se limitan a ser triturados, secados y enviados. Otras bauxitas se tratan después de la trituración mediante el lavado para eliminar parte de la arcilla, la sílice reactiva y los residuos de arena; y luego se secan en hornos rotatorios. El mineral se carga en camiones, vagones de ferrocarril o en cintas transportadoras y se transporta a barcos o refinerías.
Una serie de factores del ciclo de producción del aluminio están relacionados con el medio ambiente y se destinan considerables recursos para minimizar el impacto de la minería, el refinado y la fundición en el entorno. Se lleva a cabo la rehabilitación de la mina, haciendo todo lo posible para devolver la zona al menos a su estado original. Se tiene cuidado con la manipulación y la eliminación del lodo rojo de las refinerías. Este lodo se suele bombear en presas que se sellan con material impermeable para evitar la contaminación del paisaje circundante.
Procesamiento
En casi todas las operaciones comerciales, la alúmina se extrae de la bauxita mediante el proceso de refinado Bayer. El proceso, descubierto por Karl Josef Bayer en 1888, consta de cuatro etapas.
Digestión: la bauxita finamente molida se introduce en una unidad calentada por vapor llamada digestor. Aquí se mezcla, bajo presión, con una solución caliente de sosa cáustica. El óxido de aluminio de la bauxita (y la sílice reactiva) reacciona con la sosa cáustica formando una solución de aluminato de sodio o licor verde y un precipitado de silicato de aluminio y sodio.
Clarificación: el licor verde o solución con alúmina se separa de los residuos¿ los óxidos de hierro y la sílice no disueltos que formaban parte de la bauxita original y que ahora constituyen la arena y los residuos de lodo rojo. Esta etapa consta de tres pasos: en primer lugar, se retira el residuo de arena gruesa y se lava para recuperar la sosa cáustica; en segundo lugar, se separa el lodo rojo; y, finalmente, el licor verde restante se bombea a través de filtros para eliminar cualquier impureza residual. La arena y el lodo se bombean juntos a los lagos de residuos y el licor verde se bombea a los intercambiadores de calor donde se enfría de 1000°C a unos 650-790°C.
Precipitación: la alúmina se precipita del licor como cristales de hidrato de alúmina. Para ello, la solución de licor verde se mezcla en recipientes altos de precipitación con pequeñas cantidades de alúmina cristalina fina, lo que estimula la precipitación del hidrato de alúmina sólido a medida que la solución se enfría. Una vez completada, el hidrato de alúmina sólido pasa a la siguiente etapa y el licor restante, que contiene sosa cáustica y algo de alúmina, vuelve a los digestores.
Calcinación: el hidrato de alúmina se lava para eliminar cualquier resto de licor y luego se seca. Por último, se calienta a unos 1000°C para expulsar el agua de cristalización, dejando la alúmina, un material seco, blanco y puro, de color arena. Una parte de la alúmina puede dejarse en forma de hidrato o seguir procesándose para la industria química.
La alúmina se convierte en aluminio mediante un proceso de fundición. Toda la producción comercial de aluminio se basa en el proceso de fundición de Hall-Héroult, en el que el aluminio y el oxígeno de la alúmina se separan por electrólisis. La electrólisis consiste en hacer pasar una corriente eléctrica a través de una solución fundida de alúmina y criolita natural o sintética (fluoruro de aluminio sódico). La solución fundida está contenida en celdas de reducción o potes que están revestidos en su parte inferior con carbono (el cátodo) y están conectados en una serie eléctrica llamada potline. En la parte superior de cada olla hay ánodos de carbono, cuyos fondos están sumergidos en la solución fundida.
El paso de la corriente eléctrica hace que el oxígeno de la alúmina se combine con el carbono del ánodo formando gas de dióxido de carbono. El aluminio metálico fundido restante se acumula en el cátodo, en el fondo de la olla. Periódicamente, se sifonea y se transfiere a grandes hornos de retención. Allí se eliminan las impurezas, se añaden elementos de aleación y el aluminio fundido se funde en lingotes.
El proceso de fundición es continuo. A medida que se reduce el contenido de alúmina del baño de criolita se añade más. El calor generado por el paso de la corriente eléctrica mantiene el baño de criolita en estado fundido para que disuelva la alúmina. Durante el proceso de fundición se consume una gran cantidad de energía; se necesitan entre 14.000 y 16.000 kilovatios hora de energía eléctrica para producir una tonelada de aluminio a partir de unas dos toneladas de alúmina. El aluminio se denomina a veces «electricidad sólida» debido a la gran cantidad de energía utilizada en su producción. La disponibilidad de electricidad barata es, por lo tanto, esencial para una producción económica.
Los lingotes de aluminio se producen en varias formas y tamaños, dependiendo de su uso final. Pueden laminarse en forma de planchas, hojas, láminas, barras o varillas. También pueden convertirse en alambres que se trenzan en cables para las líneas de transmisión eléctrica. Las prensas extruyen los lingotes en cientos de formas útiles y decorativas diferentes o las plantas de fabricación pueden convertirlos en grandes formas estructurales.