¿Cómo funciona la batería de un coche y cómo está construida?
La función tradicional de la batería en el compartimento del motor es bien conocida: Sin la batería el vehículo no puede arrancar. Además del motor de arranque, las bujías, los calentadores, las luces y las aplicaciones electrónicas requieren energía eléctrica. Pero, ¿cómo se construye una batería y cómo funciona?
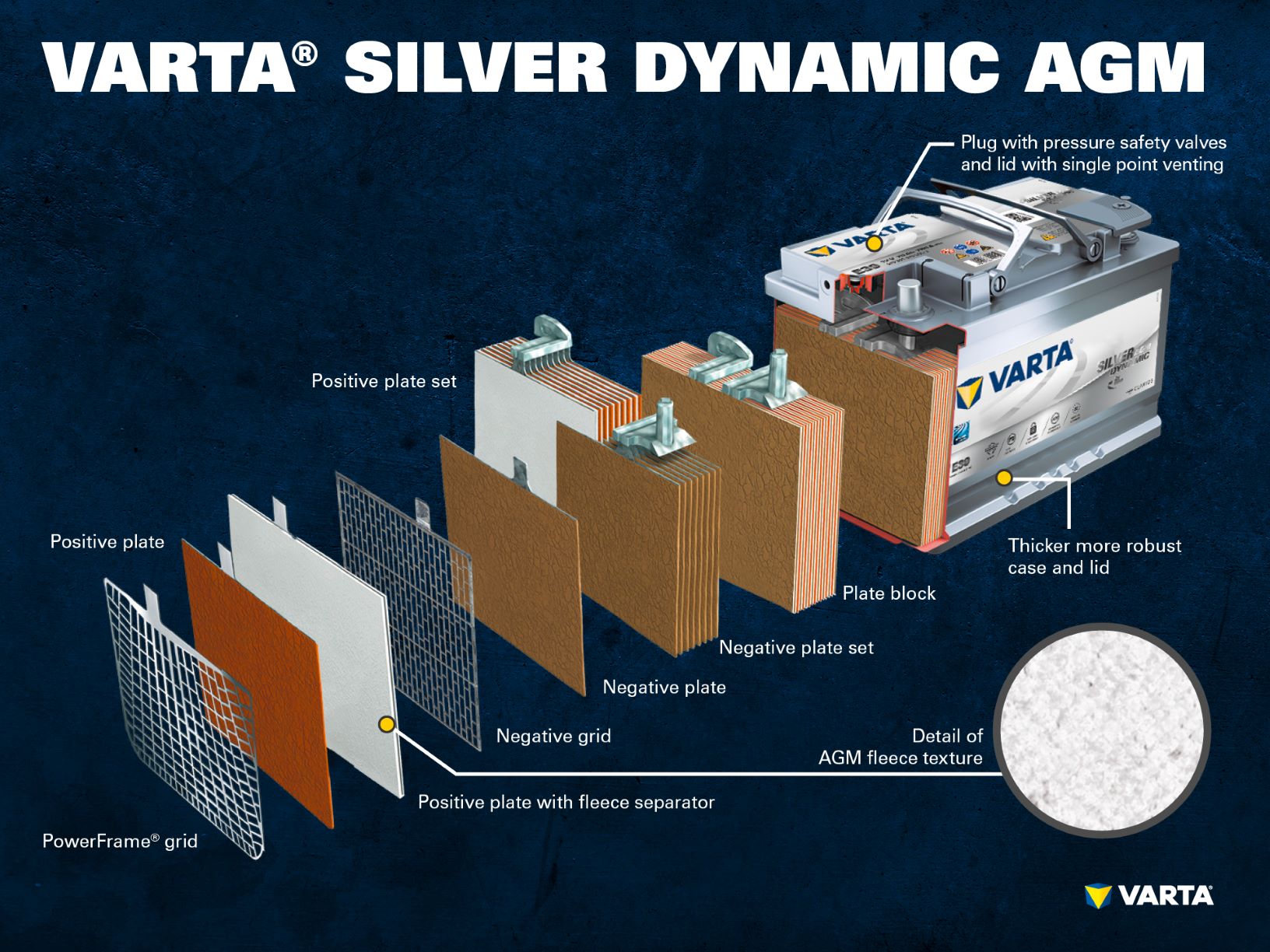
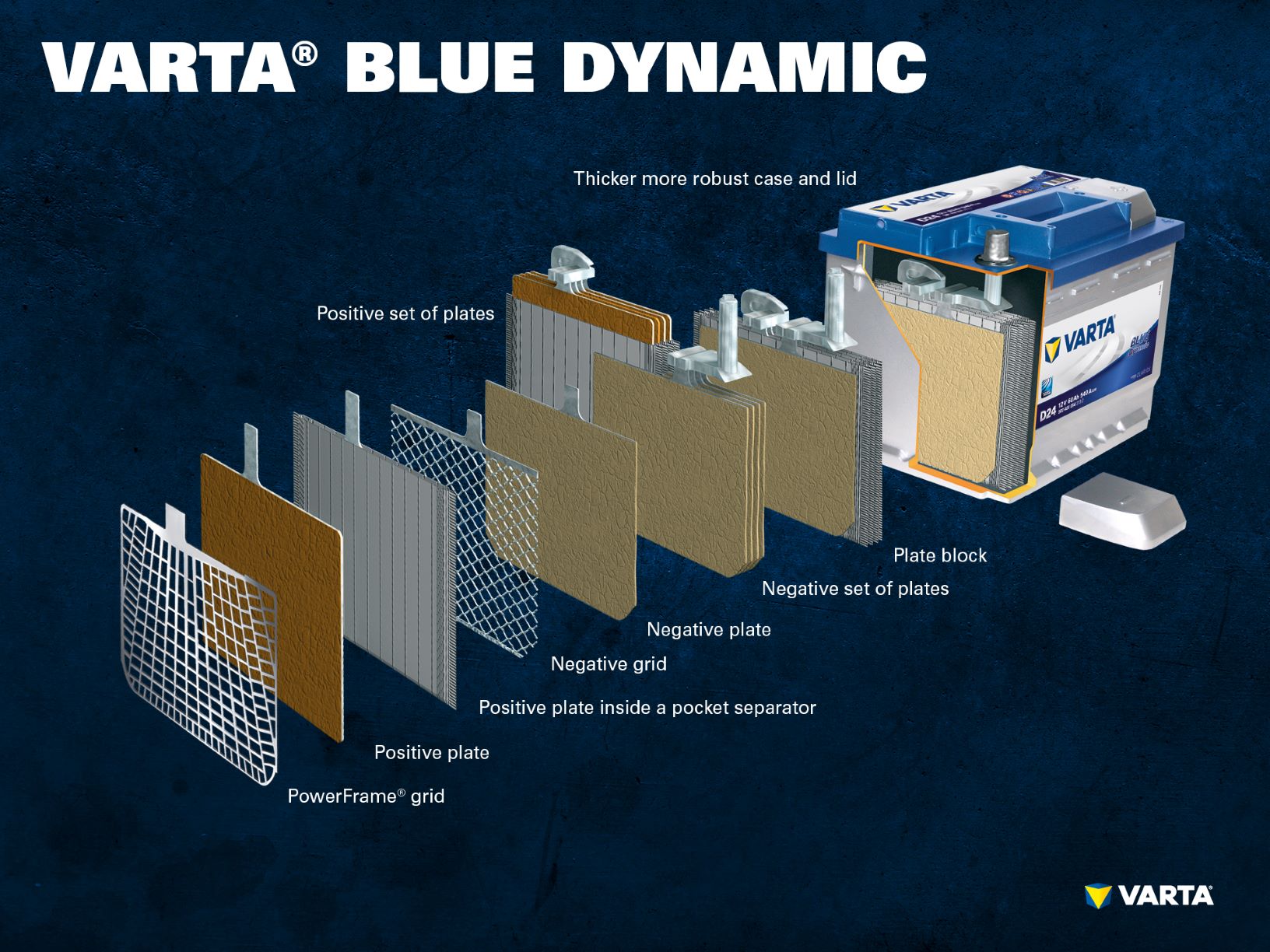
Baterías de plomo: Componentes y estructura
Muchos conductores se dan cuenta del gran peso de las baterías de los coches cuando compran una nueva. Es posible encontrar pesos desde unos 10,5 kg, hasta 30 kg. El motivo son las placas de plomo de los elementos de la batería.
Componentes y estructura de una célula de batería
Electrodo positivo:
- Placa positiva: En una batería de plomo-ácido, la placa con carga positiva (material activo) está formada por óxido de plomo (PbO2) que se sumerge en un electrolito.
- Rejilla positiva: La rejilla positiva consiste en una aleación de plomo y se utiliza para sostener el material activo y como colector de corriente.
- Placa negativa: La placa con carga negativa (material activo) está formada por plomo puro (Pb), que también está sumergido en un electrolito.
- Placa negativa: Al igual que la placa positiva, también está formada por una aleación de plomo y cumple la misma función.
- Hidrógeno (H)
- Oxígeno (O2)
- Plomo (Pb)
- Azufre (S)
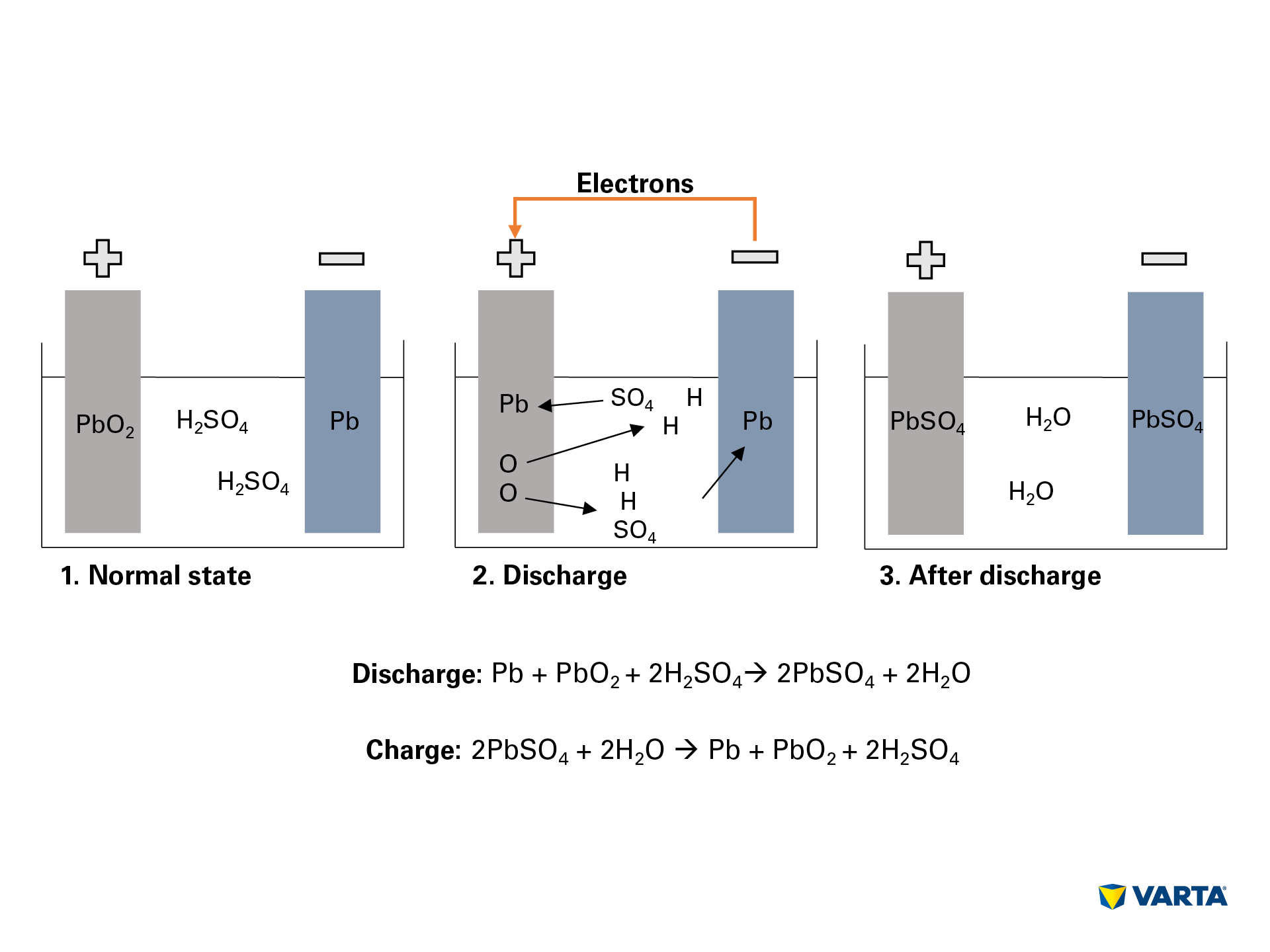
- El electrolito, una mezcla de ácido sulfúrico (H2SO4) y agua destilada se descompone en iones de hidrógeno con carga positiva (H+) e iones de sulfato con carga negativa (SO42-).
- Al mismo tiempo, los electrones (2e-) viajan desde el electrodo negativo al positivo a través del consumidor externo.
- Para compensar este flujo de electrones, los iones de sulfato viajan desde el electrolito hacia el electrodo negativo, donde reaccionan con el plomo (Pb) para producir sulfato de plomo (PbSO4).
- También se produce sulfato de plomo en el electrodo positivo: La unión del oxígeno (O2) en el óxido de plomo (PbO2) se rompe por la transferencia de electrones y el oxígeno pasa al electrolito. El plomo (Pb) restante se une con el sulfato (SO4) del electrolito.
- Allí, el oxígeno se une con el hidrógeno para formar agua (H2O). A medida que el ácido sulfúrico se consume por la formación de sulfato de plomo, la concentración de la solución electrolítica se reduce. Cuando la concentración de ácido sulfúrico cae por debajo de un determinado nivel, la batería tiene que recargarse.
- Durante la carga, los procesos químicos tienen lugar en la secuencia inversa. Al final, se pueden encontrar los elementos originales: El electrodo positivo está formado por sulfato de plomo (PbSO4), el negativo por plomo puro (Pb) y el electrolito por ácido sulfúrico diluido (H2SO4). Como este proceso de conversión está asociado a pérdidas, una batería sólo puede soportar un número limitado de ciclos de carga. Por lo tanto, su vida útil es limitada.
Electrodo negativo:
Los electrodos con cargas diferentes están separados por una bolsa separadora.
El electrolito es una mezcla de ácido sulfúrico (H2SO4) y agua destilada. Este electrolito puede estar en forma líquida (como en las baterías húmedas convencionales o en la tecnología EFB mejorada), en forma de gel o aglutinado en una estera de vidrio (como en la tecnología AGM para las nuevas aplicaciones de arranque-parada).
Varios electrodos positivos forman un conjunto de placas positivas y varios electrodos negativos forman un conjunto de placas negativas. Juntos, un conjunto de placas negativas y positivas forman un bloque de placas. Un bloque de placas es una celda de batería.
Una batería de arranque convencional consta de 6 celdas conectadas en serie, cada una con una tensión nominal de 2 V, lo que da como resultado una tensión de exactamente 12,72 V cuando la batería está completamente cargada. La capacidad y la capacidad de arranque en frío de la batería resultan del número de placas por celda.
Regla general: Cuantas más placas contenga una célula y, por tanto, formen una mayor superficie, mayor será la potencia de arranque en frío (CCA) que puede proporcionar la batería. Sin embargo, si el espacio del elemento se utiliza para menos placas, pero más gruesas, la estabilidad del ciclo aumenta. Esto significa que la batería está diseñada para un mayor rendimiento de carga (proceso continuo de carga y descarga).
Las celdas están contenidas en una carcasa que está hecha de plástico resistente al ácido (polipropileno). En una batería SLI convencional, ésta se cierra con una tapa con un sistema de laberinto que impide la salida del líquido de la batería y separa el líquido del gas.
Las primeras baterías tenían tapones de rosca que permitían rellenarlas con agua destilada. Las baterías modernas no necesitan ningún tipo de mantenimiento. El agua no necesita ni debe ser rellenada. Aunque las baterías AGM siguen teniendo «tapones unidireccionales», éstos no deben abrirse bajo ninguna circunstancia.
Función de la batería del coche: La energía química se convierte en energía eléctrica
Una batería de coche almacena energía en forma química y la convierte en energía eléctrica. En este proceso electroquímico, cuatro materiales reaccionan entre sí:
La conexión de un consumidor externo inicia la reacción química en la batería:
Problemas de las baterías de plomo: Sulfatación y estratificación del ácido
Si una batería se carga con una tensión demasiado baja, o si siempre funciona con una tensión demasiado baja (por debajo del 80%) se produce la estratificación del ácido, también denominada estratificación. El ácido del electrolito se estratifica debido a una mala mezcla. Las distintas densidades provocan la estratificación del ácido sulfúrico en el fondo y del agua en la zona superior de la batería. Debido a esto, sólo la sección media del electrolito, es decir, sólo un tercio, puede utilizarse para el proceso de descarga y carga.
Una posible causa de la estratificación del ácido son principalmente los viajes cortos con el uso simultáneo de un gran número de consumidores eléctricos. En este caso, el alternador no tiene tiempo suficiente para recargar la batería. 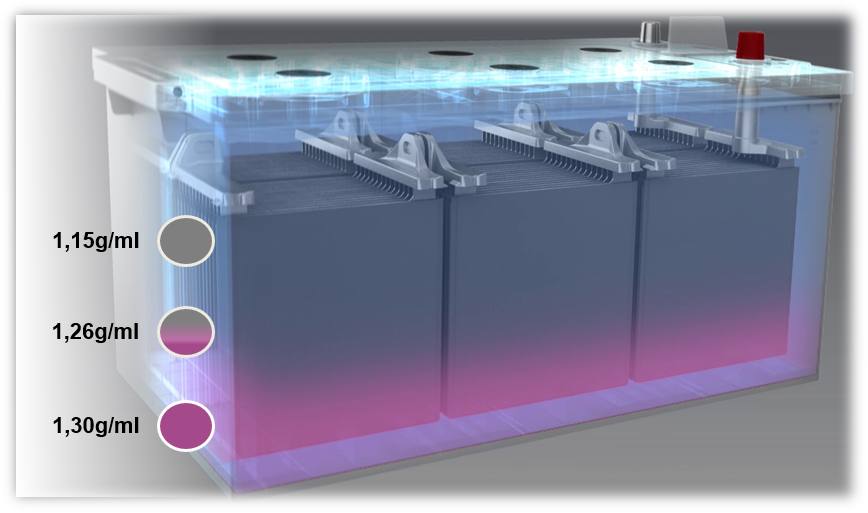
Un resultado de la estratificación de ácido es la sulfatación. Si esto ocurre en la batería, o si no se carga constantemente a un nivel adecuado, el sulfato de plomo (PbSO4) se cristaliza en los electrodos, para formar estructuras cristalinas más grandes con el paso del tiempo. Este proceso se conoce como «sulfatación». La cristalización impide la reconversión del sulfato de plomo en los componentes originales plomo u óxido de plomo, lo que provoca que no se acepte la carga y se reduzca la potencia de arranque en frío.
Los cristales afilados también pueden dañar los separadores o provocar cortocircuitos en las celdas.
Para contrarrestar este efecto y evitar el fallo prematuro de la batería, ésta nunca debe someterse a un nivel de carga bajo durante un periodo prolongado. Para ello, es aconsejable probar la batería regularmente y cargarla por completo si es necesario.
¿Quieres saber más sobre este tema? Cómo cargar correctamente una batería.
Nuevas tecnologías de baterías: AGM e iones de litio
Hasta ahora, las baterías convencionales de plomo-ácido han tenido una alta cuota de mercado. Sin embargo, el mercado está cambiando rápidamente: Las tecnologías innovadoras de baterías para vehículos de arranque-parada, como la AGM, utilizan ácido aglutinado en una estera para proporcionar una mayor estabilidad de ciclo y garantizar un rendimiento fiable en vehículos con mayores necesidades de energía. Otra ventaja de la AGM es que ya no es posible la estratificación del ácido debido al ácido ligado.
Una nueva generación de baterías de coche para vehículos microhíbridos funciona a 48V y utiliza celdas con tecnología de iones de litio.