Enfermedad de Lyme
Resumen
El primer caso de anaplasmosis humana se describió en 1990, cuando un paciente de Wisconsin desarrolló una enfermedad febril grave tras una picadura de garrapata y murió dos semanas después. Los frotis de sangre revelaron grupos de bacterias dentro de los neutrófilos del paciente, similares a las mórulas observadas en los monocitos con infección por E. chaffeensis. Sin embargo, los cultivos y las pruebas serológicas para E. chaffeensis fueron negativos. No obstante, el curso clínico del paciente sugería algún tipo de ehrlichiosis, y cuando se notificaron varios casos adicionales de la enfermedad en el norte del Medio Oeste en los años siguientes, se planteó que podría estar surgiendo una nueva especie de Ehrlichia. La nueva enfermedad recibió el nombre provisional de «ehrlichiosis granulocítica humana», o HGE.
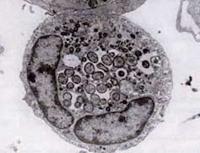
En 1994, los estudios de secuenciación del ADN revelaron que el agente de la HGE era claramente distinto de E. chaffeensis pero esencialmente idéntico a dos patógenos veterinarios ehrlichios conocidos anteriormente, E. equi y E. (Cytoecetes) phagocytophila. Bajo un nuevo esquema taxonómico implementado desde entonces, estos tres organismos se han unido como una sola especie dentro de un nuevo género, Anaplasma. La nueva especie se denomina Anaplasma phagocytophilum, y la enfermedad que causa se conoce ahora como anaplasmosis granulocítica humana, o HGA.
Al igual que las especies de Ehrlichia, los organismos de Anaplasma son pequeños, gramnegativos e intracelulares. A. phagocytophilum se dirige a los neutrófilos, altera su función en el huésped y forma mórulas dentro de las vacuolas. La mayor parte de los daños que causa parecen estar relacionados con los procesos inflamatorios del huésped, ya que hay pocas pruebas de que exista una correlación entre el número de organismos y la gravedad de la enfermedad del huésped.
La anaplasmosis es una infección mundial, que se da en América del Norte, la mayor parte de Europa y Asia oriental. Las garrapatas del complejo Ixodes persulcatus son los vectores: I. scapularis en las regiones del noreste y el medio oeste de Estados Unidos; I. pacificus en el noroeste del Pacífico; I. ricinus en Europa; e I. persulcatus en Asia. A. phagocytophilum se mantiene en la naturaleza gracias a los ciclos entre estas garrapatas y varios mamíferos pequeños, principalmente ratones y otros roedores pequeños. Dado que las garrapatas Ixodes son también los vectores de la enfermedad de Lyme, la babesiosis y la encefalitis transmitida por garrapatas, la coinfección por Anaplasma con estas otras enfermedades puede producirse y se produce en los seres humanos.
En los Estados Unidos, los casos de HGA han superado a los de la Ehrlichiosis Monocítica Humana (EMH). Al igual que la EMH y la ehrlichiosis humana, la edad media de los pacientes con HGA es de unos 50 años.
Signos y síntomas
El curso clínico de la HGA va desde la infección asintomática hasta la enfermedad mortal. Los síntomas iniciales, que aparecen entre cinco y diez días después de la picadura de la garrapata, son en gran medida inespecíficos: fiebre, escalofríos, cefalea intensa y mialgias;j también pueden aparecer náuseas, tos y artralgias. El sarpullido es infrecuente, pero se ha notificado.
En comparación con la EMH, parece menos probable que la AGH afecte al sistema nervioso central, pero las neuropatías periféricas (por ejemplo, entumecimiento y hormigueo) son más comunes y pueden durar de semanas a meses. Entre los hallazgos neurológicos descritos en la literatura médica se encuentran la parálisis facial, la polineuropatía desmielinizante y la plexopatía braquial. Se ha informado de un síndrome de dificultad respiratoria y de un síndrome similar a un shock séptico o tóxico, pero parecen ser menos comunes que en la EMH. La tasa global de mortalidad por HGA es muy baja (menos del 1%), y la mayoría de las muertes se deben a infecciones oportunistas (por ejemplo, esofagitis por herpes simple, neumonitis por Candida y aspergilosis pulmonar) en pacientes inmunodeprimidos.
Diagnóstico
Los análisis de sangre estándar en la HGA suelen revelar hallazgos similares a los observados en la HME: leucopenia, trombocitopenia y anomalías de la función hepática (transaminasas elevadas). Sin embargo, las anomalías hematológicas suelen desaparecer en la segunda semana de los síntomas, por lo que su ausencia debe interpretarse en ese contexto si los pacientes se presentan más tarde en el curso de su enfermedad. En general, debe considerarse el tratamiento antibiótico empírico para los pacientes de zonas endémicas que presenten una enfermedad febril aguda que sugiera la presencia de HGA.
Para el diagnóstico específico, los frotis de sangre teñidos con Wright o Giemsa tienen un rendimiento ligeramente superior al de la HME, pero siguen sin ser óptimos para la utilidad clínica general, dado que parece haber una amplia variación (25-75%) en la sensibilidad de estas pruebas a la hora de visualizar mórulas en los neutrófilos del huésped. Más útiles, pero no siempre disponibles, son las pruebas de reacción en cadena de la polimerasa (PCR), cuya sensibilidad se estima en un 67-90%. La terapia antibiótica previa reduce drásticamente la sensibilidad de estos dos métodos de diagnóstico.
Las pruebas serológicas son útiles para confirmar el diagnóstico de la anaplasmosis. El método más utilizado es la inmunofluorescencia indirecta (IFA) de anticuerpos IgM e IgG anti-A. phagocytophilum. La seroconversión es quizás la prueba de laboratorio más sensible de la infección por A. phagocytophilum, pero no siempre se obtiene de manera suficientemente oportuna para proporcionar información útil sobre las decisiones clínicas (es decir, el tratamiento).