Familia del oxígeno
La familia del oxígeno está formada por los elementos que componen el grupo 16 de la tabla periódica: oxígeno, azufre, selenio, telurio y polonio. Todos estos elementos tienen seis electrones en su nivel de energía más externo, lo que explica algunas propiedades químicas comunes entre ellos. En otro aspecto, los elementos son bastante diferentes entre sí. El oxígeno es un no metal gaseoso; el azufre y el selenio son no metales sólidos; el telurio es un metaloide sólido; y el polonio es un metal sólido.
Palabras a saber
Ácido: Sustancias que, disueltas en agua, son capaces de reaccionar con una base para formar sales y liberar iones de hidrógeno.
Alótropo: Una de las dos o más formas de un elemento.
Combustión: Una forma de oxidación que ocurre tan rápidamente que se produce calor y luz notables.
Craqueo: Proceso por el cual las grandes moléculas de hidrocarburos se descomponen en componentes más pequeños.
Electrólisis: Proceso por el que una corriente eléctrica provoca un cambio químico, generalmente la descomposición de alguna sustancia.
Isótopos: Dos o más formas del mismo elemento con el mismo número de protones pero diferente número de neutrones en el núcleo atómico.
Litosfera: La parte sólida de la Tierra, especialmente la región de la corteza exterior.
LOX: abreviatura de oxígeno líquido.
Metalurgia: La ciencia y la tecnología que se ocupa de obtener metales de sus minerales y convertirlos en formas que tengan valor práctico.
Oxígeno naciente: Alótropo del oxígeno cuyas moléculas contienen un solo átomo de oxígeno.
Ozono: Un alótropo del oxígeno que consta de tres átomos por molécula.
Gas productor: Un combustible sintético que consiste principalmente en gases de monóxido de carbono e hidrógeno.
Proteínas: Moléculas grandes que son esenciales para la estructura y el funcionamiento de todas las células vivas.
Decadencia radiactiva: La manera predecible en que una población de átomos de un elemento radiactivo se desintegra espontáneamente con el tiempo.
Oxígeno
El oxígeno es un gas incoloro, inodoro e insípido con un punto de fusión de -218°C (-360°F) y un punto de ebullición de -183°C (-297°F). Es el elemento más abundante en la corteza terrestre, constituyendo aproximadamente una cuarta parte de la atmósfera en peso, la mitad de la litosfera (corteza terrestre) y el 85% de la hidrosfera (océanos, lagos y otras formas de agua). Se presenta como elemento libre y en una gran variedad de compuestos. En la atmósfera, existe como oxígeno elemental, a veces conocido como dioxígeno porque está formado por moléculas diatómicas, O 2 . En el agua se presenta como óxido de hidrógeno, H 2 O, y en la litosfera se presenta en compuestos como óxidos, carbonatos, sulfatos, silicatos, fosfatos y nitratos.
El oxígeno también existe en dos formas alotrópicas (formas física o químicamente diferentes de la misma sustancia): un átomo por molécula (O) y tres átomos por molécula (O 3 ). El primer alótropo se conoce como oxígeno monatómico, o naciente, y el segundo como oxígeno triatómico, u ozono. En la mayoría de las circunstancias de la naturaleza, predomina la forma diatómica del oxígeno. Sin embargo, en la parte superior de la estratosfera, la energía solar provoca la descomposición de la forma diatómica en la forma monatómica, que puede recombinarse con moléculas diatómicas para formar ozono. La presencia de ozono en la atmósfera terrestre es fundamental para la supervivencia de la vida en la Tierra, ya que ese alótropo tiene tendencia a absorber la radiación ultravioleta que, de otro modo, sería perjudicial o incluso mortal para la vida vegetal y animal de la superficie del planeta.
El oxígeno fue descubierto de forma independiente por el químico sueco Carl Scheele (1742-1786) y el químico inglés Joseph Priestley (1733-1804) en el periodo comprendido entre 1773 y 1774. El químico francés Antoine Laurent Lavoisier (1743-1794) dio nombre al elemento a finales de la década de 1770. Su nombre proviene de la palabra francesa que significa «formador de ácidos», lo que refleja la creencia incorrecta de Lavoisier de que todos los ácidos contienen oxígeno.
Producción. El método más común para producir oxígeno comercialmente es, con mucho, la destilación fraccionada de aire líquido. Una muestra de aire se enfría primero a una temperatura muy baja en el rango de -200°C (-330°F). A esta temperatura, la mayoría de los gases que componen el aire se convierten en líquido. A continuación, se deja que el aire líquido se evapore. A una temperatura de unos -196°C (-320°F), el nitrógeno comienza a hervir. Cuando la mayor parte del nitrógeno desaparece, el argón y el neón también hierven, dejando una forma impura de oxígeno. El oxígeno es impuro porque pueden quedar pequeñas cantidades de criptón, xenón y otros gases en la forma líquida. Para purificar aún más el oxígeno, se puede repetir el proceso de enfriamiento, licuación y evaporación.
El oxígeno se suele almacenar y transportar en su forma líquida, una forma también conocida como LOX (por l iquid ox ygen). Los contenedores de LOX tienen el aspecto de botellas de vacío muy grandes que consisten en un recipiente de doble pared con vacío entre las paredes. El elemento también puede almacenarse y transportarse menos fácilmente en forma gaseosa en contenedores de paredes de acero de unos 1,2 metros (4 pies) de altura y 23 centímetros (9 pulgadas) de diámetro. En muchos casos, el oxígeno se fabrica en el lugar donde se va a utilizar. El proceso de destilación fraccionada descrito anteriormente es lo suficientemente sencillo y barato como para que muchas industrias puedan disponer de sus propias instalaciones de producción de oxígeno.
Usos. El oxígeno tiene tantos usos comerciales, industriales y de otro tipo que se encuentra constantemente entre los cinco primeros productos químicos en volumen de producción en los Estados Unidos. En 1990, por ejemplo, se fabricaron unos 18.000 millones de kilogramos (39.000 millones de libras) del elemento en Estados Unidos.
Los usos que se le dan al oxígeno pueden clasificarse en cuatro grandes categorías: metalurgia, cohetería, síntesis química y medicina. En el procesamiento del mineral de hierro en un alto horno, por ejemplo, el oxígeno se utiliza para convertir el coque (carbono) en monóxido de carbono. El monóxido de carbono, a su vez, reduce los óxidos de hierro a hierro metálico puro. A continuación, el oxígeno se utiliza en un segundo paso del procesamiento del hierro en el convertidor Bessemer, el hogar abierto o el método de proceso de oxígeno básico para convertir el «arrabio» en acero. En este paso, el oxígeno se utiliza para reaccionar con el exceso de carbono, silicio y metales que quedan en el arrabio y que deben eliminarse para producir acero.
Otra aplicación metalúrgica del oxígeno es en los sopletes utilizados para soldar y cortar. Los dos sopletes más comunes utilizan la reacción entre el oxígeno y el hidrógeno (el soplete de oxihidrógeno) o entre el oxígeno y el acetileno (el soplete de oxiacetileno). Ambos tipos de soplete producen temperaturas en el rango de 3.000°C (5.400°F) o más y pueden, por lo tanto, utilizarse para cortar o soldar la gran mayoría de los materiales metálicos.
En forma de LOX, el oxígeno se utiliza ampliamente como agente oxidante en muchos tipos de cohetes y misiles. Por ejemplo, el enorme tanque de combustible externo necesario para llevar el transbordador espacial al espacio contiene 550.000 litros (145.000 galones) de oxígeno líquido y 1.500.000 litros (390.000 galones) de hidrógeno líquido. Cuando estos dos elementos reaccionan en los motores principales del transbordador, proporcionan un empuje máximo de 512.000 libras.
La industria química utiliza grandes cantidades de oxígeno cada año en diversas reacciones de síntesis química (formación). Una de las más importantes es el craqueo de hidrocarburos por el oxígeno. En la mayoría de las circunstancias, el calentamiento de un hidrocarburo con oxígeno da lugar a una combustión, cuyos productos principales son el dióxido de carbono y el agua. Sin embargo, si se controla cuidadosamente la velocidad a la que se introduce el oxígeno en una mezcla de hidrocarburos, el hidrocarburo se «craquea», o se rompe para producir otros productos, como acetileno, etileno y propileno.
También se pueden fabricar varios tipos de combustibles sintéticos con el oxígeno como uno de los principales reactivos. El gas de producción, por ejemplo, se fabrica haciendo pasar oxígeno a un ritmo controlado a través de un lecho de carbón o coque caliente. La mayor parte del dióxido de carbono que se produce en esta reacción se reduce a monóxido de carbono, de modo que el producto final (el gas de producción) está formado principalmente por monóxido de carbono e hidrógeno.
Quizás la aplicación médica más conocida del oxígeno sea la oxigenoterapia, en la que los pacientes que tienen problemas para respirar reciben dosis de oxígeno puro o casi puro. La oxigenoterapia se utiliza a menudo durante procedimientos quirúrgicos, durante el parto, durante la recuperación de ataques cardíacos y durante el tratamiento de enfermedades infecciosas. En cada caso, proporcionar a una persona oxígeno puro reduce el esfuerzo de su corazón y sus pulmones, acelerando el ritmo de recuperación.
El oxígeno puro o el aire enriquecido con oxígeno también puede suministrarse en entornos en los que la respiración puede ser difícil. Los aviones que vuelan a gran altura, por supuesto, siempre llevan suministros de oxígeno en caso de que haya algún problema con el suministro de aire normal de la nave. Los buceadores de aguas profundas también llevan consigo o tienen bombeados suministros de aire enriquecido con oxígeno.
Algunas plantas de purificación de agua y de tratamiento de aguas residuales utilizan oxígeno. El gas se bombea a través del agua para aumentar la velocidad a la que las bacterias naturales descomponen los materiales orgánicos de desecho. Se ha descubierto que un proceso similar reduce el ritmo de eutrofización de los lagos y estanques y, en algunos casos, incluso invierte ese proceso. (La eutrofización es la disolución de nutrientes en una masa de agua. El crecimiento de la vida vegetal acuática y la disminución del oxígeno disuelto son los dos principales resultados del proceso).
Por último, el oxígeno es esencial para toda la vida animal en la Tierra. Una persona puede sobrevivir unos días o semanas sin agua o comida, pero no más de unos minutos sin oxígeno. En ausencia de oxígeno, las reacciones químicas generadoras de energía que tienen lugar dentro de las células llegarían a su fin, y una persona moriría.
El azufre
El azufre es un elemento no metálico que puede existir en muchas formas alotrópicas (formas física o químicamente diferentes de la misma sustancia). Las más conocidas son el azufre rómbico y el monoclínico. Ambas son sólidos de color amarillo brillante con puntos de fusión de unos 115°C (239°F). Una tercera forma se llama azufre plástico o amorfo. Es un líquido de color marrón que se produce cuando se funde el azufre rómbico o monoclínico.
El azufre en sí no tiene ningún olor. Sin embargo, tiene una mala reputación en este sentido, porque algunos de sus compuestos más comunes tienen fuertes olores. El dióxido de azufre, uno de estos compuestos, tiene un efecto agudo, asfixiante y sofocante en cualquiera que lo respire. El «fuego y azufre» de la Biblia era uno de los peores castigos que sus autores podían imaginar. El azufre en esta expresión se refería al azufre ardiente, o dióxido de azufre. El hecho de que el azufre provenga de las profundidades de la tierra y que el dióxido de azufre se pueda oler en las emanaciones de los volcanes alimentó aún más la imaginación de la gente sobre cómo debía ser el infierno.
Un segundo compuesto de azufre con mal olor es el sulfuro de hidrógeno. El fuerte olor a huevos podridos se debe a la presencia de este compuesto.
Ocurrencia y preparación. El azufre es el decimosexto elemento más abundante en la corteza terrestre. Se presenta tanto como elemento como en una variedad de compuestos. Como elemento, puede encontrarse en grandes minas subterráneas, sobre todo a lo largo de la costa del Golfo de los Estados Unidos y en Polonia y Sicilia. El azufre se extrae de estas minas mediante el proceso Frasch. En este proceso, se bombea vapor sobrecalentado a través del más externo de un conjunto de tres tubos. El aire comprimido se introduce por la tubería más interna. El vapor sobrecalentado hace que el azufre subterráneo se derrita, y el aire comprimido lo impulsa hacia arriba, a través del medio de los tres tubos, hasta la superficie de la Tierra.
El azufre también está ampliamente distribuido en forma de minerales y menas. Muchos de ellos están en forma de sulfatos, como el yeso (sulfato de calcio, CaSO 4 ), la barita (sulfato de bario, BaSO 4 ) y las sales de Epsom (sulfato de magnesio, MgSO 4 ). Otros son sulfuros metálicos, como las piritas de hierro (sulfuro de hierro, FeS 2 ), la galena (sulfuro de plomo, PbS), el cinabrio (sulfuro de mercurio, HgS), la estibina (sulfuro de antimonio, Sb 2 S 3 ) y la blenda de zinc (sulfuro de zinc, ZnS). El azufre se recupera de estos minerales metálicos calentándolos fuertemente en el aire, lo que convierte el azufre en dióxido de azufre y libera el metal puro. Entonces, el dióxido de azufre puede ir directamente a la fabricación de ácido sulfúrico, que es donde acaba más del 90 por ciento del azufre extraído en el mundo.
Usos del azufre y sus compuestos. Parte del azufre se utiliza directamente como fungicida e insecticida, en cerillas, fuegos artificiales y pólvora, y en la vulcanización del caucho natural (un tratamiento que da elasticidad y resistencia al caucho). La mayor parte, sin embargo, se convierte en una multitud de compuestos útiles.
El ácido sulfúrico es, con mucho, el más importante de todos los compuestos de azufre. Casi el 90% de todo el azufre producido se convierte primero en dióxido de azufre y luego en ácido sulfúrico. Este ácido ocupa sistemáticamente el primer lugar entre los productos químicos producidos en Estados Unidos. En 1990, se fabricaron más de 40.000 millones de kilogramos de ácido sulfúrico, más del 50% que el segundo producto químico más popular (el gas nitrógeno). El ácido sulfúrico se utiliza en la producción de fertilizantes, baterías de automóviles, productos petrolíferos, pigmentos, hierro y acero, y muchos otros productos.
El ciclo del azufre. Al igual que el nitrógeno, el carbono y el fósforo, el azufre pasa por las partes gaseosa, líquida y sólida de nuestro planeta en una serie de reacciones continuas conocidas como el ciclo del azufre. Los principales pasos del ciclo del azufre se ilustran en la figura adjunta.
El azufre se produce de forma natural como resultado de las erupciones volcánicas y a través de las emisiones de las aguas termales. Entra en la atmósfera principalmente en forma de dióxido de azufre, y luego permanece en la atmósfera en esa forma o, tras reaccionar con el agua, en forma de ácido sulfúrico. El azufre vuelve a la superficie de la Tierra en forma de deposición ácida cuando llueve o nieva.
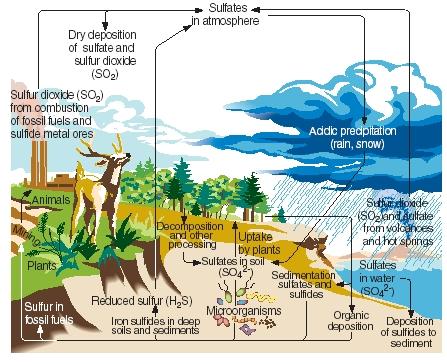
.)
En la superficie de la Tierra, el dióxido de azufre y el ácido sulfúrico reaccionan con los metales para formar sulfatos y sulfuros. El elemento también es incorporado por las plantas en una forma conocida como azufre orgánico. Algunos aminoácidos, los compuestos con los que se fabrican las proteínas, contienen azufre. El azufre orgánico de las plantas acaba pasando a los animales que se alimentan de ellas. A su vez, se convierte de proteínas vegetales a proteínas animales.
Cuando las plantas y los animales mueren, el azufre es devuelto al suelo donde es convertido por los microorganismos en sulfuro de hidrógeno. El gas de sulfuro de hidrógeno se devuelve a la atmósfera, donde se oxida a ácido sulfúrico.
Las actividades humanas influyen en el ciclo del azufre de varias maneras. Por ejemplo, cuando se extrae carbón y minerales metálicos, el azufre y los sulfuros pueden ser liberados y devueltos al suelo. Además, la combustión de carbón, petróleo y gas natural a menudo libera dióxido de azufre a la atmósfera. Este dióxido de azufre se añade a la cantidad ya presente de fuentes naturales, aumentando en gran medida la cantidad de precipitación ácida que cae a la superficie de la Tierra. Algunas personas creen que la precipitación ácida (o lluvia ácida) es responsable de la muerte de árboles y otras plantas, la acidificación de los lagos que ha perjudicado a los animales marinos, el daño a las estructuras de metal y piedra, y otros daños ambientales.
Selenio, telurio y polonio
El selenio y el telurio son elementos relativamente raros. Se encuentran en el diez por ciento inferior de todos los elementos en términos de abundancia. Suelen aparecer en la corteza terrestre asociados a minerales de cobre y otros metales. Ambos se obtienen como subproducto del refinado electrolítico del cobre. Durante ese proceso, se hunden en el fondo de la cuba de electrólisis, donde pueden ser retirados de los lodos que se forman.
El selenio se presenta en una variedad de formas alotrópicas (formas física o químicamente diferentes de la misma sustancia), la más común de las cuales es un polvo rojo que se vuelve negro cuando se expone al aire. El punto de fusión del elemento es de 217°C y su punto de ebullición es de 685°C. El telurio es un sólido blanco plateado que parece un metal (aunque en realidad es un metaloide). Su punto de fusión es de 450°C (842°F), y su punto de ebullición es de 990°C (1.814°F).
El selenio tiene un papel interesante en los organismos vivos. Es esencial en concentraciones muy bajas para mantener la salud en la mayoría de los animales. De hecho, a menudo se añade a los alimentos para animales. Sin embargo, en concentraciones más altas, se ha descubierto que el elemento tiene efectos nocivos en los animales, causando crías deformes y adultos enfermos.
Los principales usos del selenio son la electrónica y la fabricación de vidrios de colores. Las máquinas fotocopiadoras, las células solares, las fotocélulas, los tubos de televisión y los rectificadores y relés electrónicos (utilizados para controlar el flujo de la corriente eléctrica) utilizan selenio. Algunos de los vidrios de colores más bellos, que van desde el rosa pálido hasta el rojo brillante, se fabrican con compuestos de selenio.
También se utilizan pequeñas cantidades de telurio en la producción de vidrio de color. Sin embargo, más del 90 por ciento del elemento se destina a la producción de aleaciones de hierro y otros metales.
El polonio tiene 27 isótopos, todos ellos radiactivos. Se encuentra de forma natural en los minerales de uranio, donde es el producto final de la larga serie de reacciones por las que el uranio sufre una desintegración radiactiva. Es uno de los elementos más raros de la Tierra, con una abundancia que no supera las 3 × 10 -10 partes por millón. El descubrimiento del polonio en 1898 por la química polaco-francesa Marie Curie (1867-1934) es uno de los hechos más dramáticos de la historia de la ciencia. Procesó toneladas de mineral de uranio para obtener unos pocos miligramos del nuevo elemento, al que dio el nombre de su patria, Polonia. El polonio tiene un uso limitado en dispositivos altamente especializados de generación de energía, como los utilizados en los satélites y las sondas espaciales.