Fronteras de la Neurología
Introducción
La parálisis de la mirada horizontal bilateral es una presentación poco frecuente causada por la interrupción bilateral del fascículo longitudinal mediano, el núcleo abducens o la formación reticular pontina paramediana (1, 2). Los tipos de movimientos oculares que pueden verse afectados en las lesiones del tronco cerebral incluyen los movimientos oculares lentos horizontales y verticales, los movimientos de persecución, las respuestas vestibulares y optocinéticas, y los movimientos oculares rápidos, incluidas las sacadas voluntarias o evocadas y las fases rápidas de los estímulos vestibulares y optocinéticos. El control de la vergencia puede verse afectado por las lesiones del cerebro medio.
La parálisis de la mirada horizontal se ha descrito como consecuencia de un infarto (3), de la inflamación/desmielinización como parte de la esclerosis múltiple (EM) o de los trastornos del espectro de la neuromielitis óptica (NMOSD) (2, 4, 5), de una hemorragia (6) y de una metástasis (7). De los casos no vasculares/tumorales comunicados anteriormente, cinco de los seis tenían parálisis horizontales de la mirada bilaterales y tres tenían lesiones solitarias en la resonancia magnética (RM), localizadas en el tegmento pontino. Milea et al. (1) informaron de dos casos de oftalmoplejía internuclear bilateral (INO) que se transformaron en parálisis de la mirada horizontal bilateral con lesiones solitarias que realzaban en T2 en la misma localización y con la misma morfología que nuestra serie de casos. Sugirieron la EM como diagnóstico probable.
Henderson describió un paciente con diplopía horizontal en la mirada lateral izquierda y debilidad en la aducción (8). La resonancia magnética cerebral demostró una lesión solitaria hiperintensa en T2 del tallo cerebral adyacente al cuarto ventrículo, y se hizo el diagnóstico de EM. En ausencia de información clínica adicional, es difícil discernir cómo se hizo este diagnóstico. Matsui et al. informaron de un paciente que se quejaba de diplopía horizontal con paresia de la mirada horizontal bilateral (9). Se hizo un diagnóstico de encefalitis del tallo cerebral de Bickerstaff (BBE), aunque las características clínicas eran inconsistentes con los criterios de diagnóstico (10).
Aquí, describimos tres pacientes con paresia horizontal bilateral de la mirada, causada en cada caso por una lesión solitaria e inflamatoria que afecta al tegmento dorsal del puente de Varolio y que se extiende hacia delante hasta la región del fascículo longitudinal mediano (MLF). Creemos que estos tres casos ponen de relieve cuestiones relativas a la patogénesis de tales síndromes y la relación de la proyección horizontal y vertical relacionada con la mirada en el MLF en particular.
De acuerdo con los requisitos éticos de nuestra institución, el Royal Melbourne Hospital, se obtuvo el consentimiento informado y por escrito para el uso de datos anónimos de todos los pacientes.
Paciente 1
Un hombre de 38 años de origen turco se presentó con diplopía aguda intermitente, mareos y vómitos; se le diagnosticó vértigo periférico y fue dado de alta. Una semana después, volvió a presentarse con adormecimiento facial del lado izquierdo. Sus antecedentes médicos personales, la revisión de los sistemas y los antecedentes familiares no eran destacables.
La agudeza visual era de 0,63 OU, medida en la escala decimal. El diámetro pupilar era de 5 mm bilateralmente y no reactivo. El examen de la motilidad ocular (Tabla 1) reveló un fallo completo de todos los movimientos oculares horizontales, sacadas voluntarias, seguimiento suave, movimientos vestibulares y optocinéticos. Las sacadas verticales, el seguimiento suave y los movimientos vestibulares estaban intactos al examen clínico, pero esto no excluye la posibilidad de un enlentecimiento menor que habría requerido una oculografía para su identificación. El examen neurológico fue por lo demás normal.
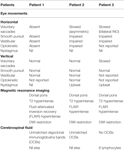
Tabla 1. Resumen de los hallazgos clínicos oculomotores, los hallazgos de las imágenes de resonancia magnética y los resultados del LCR.
La resonancia magnética cerebral mostró una lesión triangular hiperintensa en T2 y recuperación de inversión atenuada por fluidos (FLAIR) dentro de la protuberancia dorsal en el suelo del cuarto ventrículo (Figura 1A). La lesión mostraba una leve restricción de la difusión en el mapeo del coeficiente de difusión aparente, en consonancia con los informes publicados sobre lesiones inflamatorias/desmielinizantes (11, 12), y no mostraba realce del contraste. Por lo demás, la resonancia magnética del cerebro y de la columna vertebral no presentaba ninguna anomalía. Se consideró que la lesión del tallo cerebral tenía características consistentes con la desmielinización, aunque no se observaron más lesiones. Se consideraron como diagnósticos diferenciales la enfermedad de Behçet, la vasculitis o una lesión mitótica.
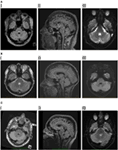
Figura 1. (A) I. Paciente 1, recuperación de inversión atenuada por líquido (FLAIR) axial que muestra lesión hiperintensa en tegmento pontino posterior. II. FLAIR sagital mostrando la extensión vertical de la lesión. III. Imagen ponderada por difusión que muestra una leve restricción de la difusión. (B) I. Paciente 2, dual axial mostrando lesión hiperintensa en tegmento pontino posterior. II. FLAIR sagital que muestra la extensión vertical de la lesión. III. Imagen ponderada por difusión que muestra una leve restricción de la difusión. (C) I. Paciente 3, FLAIR axial mostrando lesión hiperintensa en tegmento pontino posterior, ligeramente más significativa en el lado derecho. II. FLAIR sagital mostrando la extensión vertical de la lesión, ligeramente mayor que en los dos pacientes anteriores, consistente con la existencia de un cierto enlentecimiento de las sacadas verticales. III. Imagen ponderada por difusión que muestra una leve restricción de la difusión.
El análisis del líquido cefalorraquídeo (LCR) reveló tres linfocitos, ningún polimorfo y ningún glóbulo rojo, se observaron bandas de inmunoglobulinas oligoclonales (BIO) en el LCR y no coincidían en el suero. Había una proteína mínimamente elevada (0,46 g/l), pero las pruebas fueron negativas para la anti-aquaporina 4 (Aq4). El Aq4 en suero también fue negativo. No se realizaron pruebas de anticuerpos antigangliósidos y los anticuerpos contra la glicoproteína oligodendrocitaria de mielina (MOG) no estaban disponibles en el momento de la enfermedad aguda, pero fueron negativos cuando estuvieron disponibles 2 años después.
El paciente fue tratado por presunta desmielinización y mejoró después de 3 días de 1 g de metilprednisolona intravenosa (IV). Su examen neurológico había vuelto a la normalidad en la revisión 3 semanas después del alta. Las resonancias magnéticas cerebrales seriadas han demostrado la resolución completa de la lesión pontina, sin que se observen nuevas lesiones, y sin más episodios clínicos durante 2 años desde la presentación inicial.
Paciente 2
Una mujer de 46 años que presentaba cefalea frontal fue tratada por migraña y respondió inicialmente a naproxeno y amitriptilina. Seis días más tarde, volvió a presentarse con un empeoramiento de la cefalea, fotofobia, visión borrosa, diplopía horizontal intermitente y entumecimiento facial fluctuante.
Su historia clínica y sus antecedentes familiares no eran destacables. El examen neurooftálmico reveló una agudeza visual de 0,32 OU. Las respuestas pupilares fueron reportadas como ligeramente lentas pero reactivas bilateralmente. El examen oculomotor se resume en la Tabla 1. Había una paresia horizontal bilateral asimétrica, la derecha peor que la izquierda. Las sacadas hacia la derecha eran restringidas en amplitud y lentas. Las respuestas vestibulares eran asimétricas con movimientos oculares evocados por la maniobra de la cabeza de la muñeca que eran normales en el ojo izquierdo pero restringidos en el derecho. Las respuestas de empuje de cabeza más activas eran hipoactivas bilateralmente. El nistagmo ascendente era más evidente en la mirada hacia arriba, pero con la oftalmoscopia se observó también en la posición primaria. Las sacadas verticales, hacia arriba y hacia abajo eran normales. El seguimiento vertical suave parecía intacto. Los empujes verticales de la cabeza y las respuestas optocinéticas eran clínicamente normales. No se disponía de video oculografía y, en general, estos hallazgos se interpretaron como consistentes con un deterioro leve de la mirada vertical. El nistagmo vertical se resolvió en 2 días. También tenía una leve debilidad facial bilateral, ausencia de reflejos tendinosos en los miembros superiores y una leve ataxia de la marcha. La impresión clínica fue que su constelación de síntomas era consistente con el síndrome de Miller Fisher, BBE o desmielinización central, pero sin evidencia para confirmar el diagnóstico de estas entidades en las pruebas.
La resonancia magnética cerebral reveló un foco paramediano solitario y bien definido de hiperintensidad T2 en la protuberancia dorsal que mostraba una difusión ligeramente restringida pero sin realce de contraste (Figura 1B). La resonancia magnética de la columna vertebral era normal.
Los estudios de conducción nerviosa revelaron una neuropatía axonal motora facial bilateral. El análisis del LCR demostró OCBs (no coincidentes) y albúmina elevada (298 mg/l). El anticuerpo Aq4 en suero fue negativo. Los resultados rutinarios del LCR fueron normales, incluyendo proteínas de 0,4 g/l, recuento de glóbulos blancos (WCC) y de glóbulos rojos (RCC) < 1. El LCR fue negativo para anticuerpos anti-AQP4, anti-GM1, anti-GQ1B y anti-proteína de mielina-oligodendrocitos.
El diagnóstico fue el de una encefalitis localizada restringida a la protuberancia y que afectaba principalmente al tegmento dorsal. El paciente fue tratado con un curso de 5 días de 2 g/kg de inmunoglobulina IV. Durante la semana siguiente, la oftalmoplejía mejoró significativamente, los reflejos de los miembros superiores mejoraron y la ataxia se resolvió. No se identificaron nuevos síntomas o lesiones durante los 12 meses de seguimiento. La revisión a los 18 meses confirmó la recuperación clínica completa.
Paciente 3
Este hombre de 29 años se despertó con sudores y escalofríos, seguidos de cefalea bifrontal, vértigo postural, náuseas y vómitos. Al presentarse 12 horas después, tenía diplopía horizontal y adormecimiento del lado derecho. Declaró una historia de 5 días de síntomas del tracto respiratorio superior, senos bloqueados y un refuerzo de la vacuna contra la tos ferina 1 mes antes del inicio de los síntomas. Sus antecedentes incluían hipertensión, hipotiroidismo, ansiedad, síndrome del intestino irritable, obesidad y esteatohepatitis no alcohólica.
La resonancia magnética cerebral reveló una lesión hiperintensa pontina dorsal T2 en el lado izquierdo, que demostró una difusión restringida (Figura 1C). El LCR destacaba por un elevado CMI de 8 × 106/l (7 linfocitos, 1 neutrófilo), el CCR era de 4 × 106/l y las proteínas del LCR eran de 0,35 g/l. Inicialmente se diagnosticó como ictus isquémico, en otra institución, y se inició un tratamiento médico de prevención secundaria. No se encontraron anomalías en la angiografía por resonancia magnética, la monitorización cardíaca, el ecocardiograma transesofágico, la vasculitis y las pruebas de trombofilia.
Dos semanas después del inicio desarrolló alteración del gusto en el lado izquierdo, lengua izquierda, interior de la boca y entumecimiento facial. Su agudeza visual monocular era de 1,0 OU, pero la agudeza visual dinámica era de 0,4 OU. Las respuestas de las pupilas eran normales. Demostró paresia bilateral de la mirada e INO (Tabla 1). Las respuestas de empuje de la cabeza eran bilateralmente hipoactivas con sacadas ascendentes ligeramente lentas y nistagmo ascendente en la mirada. El resto de la exploración neurológica reveló una leve dismetría izquierda solamente.
La repetición del análisis del LCR reveló 3 leucocitos (indiferenciados), 27 glóbulos rojos, y negativo para OCB. La RMN cerebral sin contraste reveló un agrandamiento de la lesión con difusión restringida persistente. Las apariencias fueron reportadas consistentes con desmielinización. Los anticuerpos antigangliósidos en suero, el anticuerpo antiaquaporina-4 (AQP4) y los anticuerpos anti-MOG fueron negativos.
Fue tratado con un curso de 3 días de 1 g diario de metilprednisolona intravenosa seguido de 60 mg de prednisolona oral al día, destetado lentamente después de 1 mes. Un examen de seguimiento 8 semanas después de la primera presentación demostró un INO izquierdo residual y síntomas sensoriales derechos solamente, y estos se resolvieron en los meses siguientes. La lesión se resolvió completamente en las imágenes de seguimiento 3 meses después.
Discusión
Describimos tres casos de paresia horizontal bilateral de la mirada, coincidentes con el desarrollo agudo de una lesión pequeña y bien circunscrita del tegmento pontino en la RM. Por definición, estos casos representan síndromes clínicamente aislados pero en ausencia de lesiones recurrentes en 12-36 meses de seguimiento. El fenotipo está descrito en la EM, la NMOSD, el ictus y el tumor (1, 4, 5, 8, 9, 13, 14). Sin embargo, los pacientes con estos diagnósticos tienden a desarrollar recaídas y cambios característicos en la RM (4, 15). En nuestros casos, no hay evidencia suficiente para ninguno de estos diagnósticos en la presentación o en el seguimiento. Nos centramos aquí en las novedades clínicas y anatómicas propuestas que demuestran.
Los trastornos del espectro anti-GQ1b pueden afectar a los movimientos oculares y podrían presentarse potencialmente con las características clínicas que describimos. El síndrome de solapamiento Miller-Fisher/BBE se consideró en el segundo caso, pero estos pacientes tienden a presentarse con anticuerpos anti-GQ1B positivos y una resonancia magnética cerebral normal (13). Por ello, creemos que es más probable un diagnóstico alternativo. Aunque la NMOSD puede presentarse con lesiones inflamatorias cerca del tegmento pontino, éstas son característicamente más bajas en el suelo del cuarto ventrículo. Estos casos reportados aquí no cumplen con los criterios recientemente actualizados para NMOSD (16).
De manera similar, el síndrome de CLIPPERS es un trastorno inflamatorio del tallo cerebral, pero es clínica y radiológicamente más difuso y es poco probable que sea una explicación en nuestros pacientes (17).
El control de la mirada vertical se atribuye generalmente al mesencéfalo rostral, al núcleo intersticial rostral de la MLF (riMLF) que contiene células de ráfaga, y al núcleo intersticial de Cajal que forma el integrador neural para el mantenimiento de la posición en la órbita. Estas regiones se proyectan bilateralmente, en parte a través de la comisura posterior. Las entradas a estas áreas proceden de varias fuentes, que dependen en parte del tipo de entrada.
Las entradas vestibulares proceden de los núcleos vestibulares superiores bilateralmente, mientras que las señales de seguimiento suave se proyectan desde el grupo de células Y a la riMLF. Las vías incluyen la FML, el tracto tegmental ventral y las vías cerebelosas. Las sacadas verticales voluntarias y reflejas, determinadas por redes supratentoriales, parecen depender de las proyecciones de la región de la PPRF bilateralmente, y son abolidas por lesiones localizadas de la PPRF caudal bilateralmente solamente (18). Se ha demostrado una fuerte proyección de neuronas omnipresentes desde la PPRF, bilateralmente, a la riMLF (19, 20). Estas deben estar inhibidas para que se generen sacadas voluntarias y reflexivas, no fases rápidas (21).
La mirada vertical puede estar salvada en presencia de oftalmoplejia horizontal con una lesión tegmental pontina posterior con o sin patología más extendida (1, 13). Aunque las lesiones puras del abducens pueden producir parálisis de la mirada horizontal, los casos reportados por Milea et al. se presentaron tempranamente con INO bilateral, lo que sugiere la afectación de la FML o de las proyecciones bilaterales a la FML.
La lesión unificadora, en nuestros pacientes y en los referidos aquí, es la lesión tegmental posterior. Esta lesión se encuentra muy cerca de los núcleos abductores y de la PPRF que contiene las células excitadoras de la mirada horizontal. La afectación bilateral de las proyecciones del PPRF o de los núcleos abductores explicaría la parálisis de la mirada horizontal. La relativa preservación de los movimientos oculares verticales implica que las señales verticales bilaterales que se proyectan al centro de la mirada vertical de la formación reticular mesencefálica a través de la FML (22), recorren una vía distinta en el puente de Varolio, en comparación con las entradas de la mirada lateral. Esto es consistente con la evidencia de Pierrot-Deseilligny et al. (7), sobre la parálisis de la mirada horizontal bilateral disociada, pero está en desacuerdo con la percepción clínica convencional actual de la anatomía en esta área.
Si hay lesiones bilaterales de los centros de la mirada lateral en la PPRF, estrechamente asociados y casi indistinguibles del núcleo abducens, la sabiduría convencional indicaría que debería haber parálisis de la mirada vertical también ya que se dice que esas vías corren juntas. Ciertamente, las lesiones de la línea media que afectan a ambos fascículos longitudinales medios (FML) producen INO bilateral que se asocia característicamente con paresia de la mirada vertical, caracterizada por una alteración del seguimiento suave vertical y la cancelación del reflejo vestíbulo-ocular (23). Las lesiones más rostrales pueden afectar a las estructuras del cerebro medio (riMLF e INC) que participan en las sacadas verticales (24). En nuestros pacientes no se observa esta afectación de la mirada vertical.
Sugerimos que las vías de la mirada vertical y horizontal discurren por separado en su curso inferior y se fusionan en su curso rostral, con las entradas de la mirada vertical discurriendo anterolateralmente a las entradas de la mirada horizontal. Es posible que se crucen en su ascenso, probablemente de forma sustancial, de manera que se requieren lesiones bilaterales para producir una parálisis de la mirada vertical. Esto explicaría la preservación de la vía directa para la mirada vertical desde el PPRF lateral en presencia de una lesión unilateral, la abolición de los movimientos oculares verticales con lesiones bilaterales localizadas, y el requisito de estimulación bilateral para provocar movimientos oculares verticales (18, 22).
Proponemos una disposición anatómica ligeramente alterada para representar esto (Figura 2). Las vías de la mirada horizontal se proyectan al núcleo abducens ipsilateral y luego ascienden en la FML hasta el subnúcleo del recto medial contralateral del núcleo del tercer nervio. Proponemos que la señal de la mirada vertical se proyecta más anteriormente en la FML y, al menos en una distancia corta, es separable de las vías de fibras de la mirada horizontal.
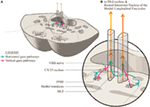
Figura 2. (A) Una sección a través de la parte media del póndilo que muestra la relación de la formación reticular pontina paramediana con el fascículo longitudinal mediano (MLF) y el séptimo nervio craneal adyacente a medida que barre alrededor del núcleo abducens. (B) Una ampliación que muestra la conformación propuesta de las trayectorias de la mirada horizontal y vertical separadas a medida que se proyectan en el MLF. La señal horizontal se decanta a nivel de la protuberancia y asciende en la FML contralateral, mientras que no se sabe con certeza si la señal de la mirada vertical se decanta del todo o es una proyección directa.
Las similitudes en el fenotipo y la morfología de las lesiones causales en estos casos sugieren que esta región del tegmento pontino puede tener características particulares que la hacen susceptible al ataque inmunológico. Ninguno de estos casos cumple los criterios de otras enfermedades, inflamatorias o de otro tipo, asociadas a la afectación de la FML.
Si realmente estos casos representan un fenotipo novedoso, entonces es necesario discernir el curso óptimo del tratamiento, tanto durante la fase aguda como a largo plazo. Un diagnóstico erróneo, por ejemplo de esclerosis múltiple o accidente cerebrovascular, puede exponer al paciente a un tratamiento antiplaquetario o inmunomodulador innecesario a largo plazo y a la ansiedad por el diagnóstico de una enfermedad significativa y potencialmente recurrente a largo plazo, con el consiguiente impacto adverso en sus opciones de vida.
La identificación de otros casos de este fenotipo sería útil para facilitar la búsqueda de nuevos anticuerpos específicos que puedan estar en juego aquí y para dilucidar el curso de tratamiento más apropiado y eficaz.
Contribuciones de los autores
RE revisó los archivos y las imágenes de los pacientes, recopiló los datos y construyó las presentaciones preliminares, además de contribuir a la edición en curso del manuscrito final presentado. OW supervisó RE en la recogida de los datos y participó en todos los niveles de la escritura y la interpretación de los datos, así como la revisión y edición del manuscrito final a continuación. AB trabajó con RE en el análisis de los datos, la revisión de la literatura relevante, la interpretación de los hallazgos y la preparación del manuscrito.
Declaración de conflicto de intereses
Esta investigación no fue apoyada financieramente por ningún interés comercial. No existen relaciones financieras que puedan interpretarse como un potencial conflicto de intereses.
1. Milea D, Napolitano M, Dechy H, Le Hoang P, Delattre J-Y, Pierrot-Deseilligny C. Complete bilateral horizontal gaze paralysis disclosing multiple sclerosis. J Neurol Neurosurg Psychiatry (2001) 70(2):252-5. doi:10.1136/jnnp.70.2.252
PubMed Abstract | CrossRef Full Text | Google Scholar
2. Tan E, Kansu T. Bilateral horizontal gaze palsy in multiple sclerosis. J Clin Neuroophthalmol (1990) 10(2):124–6.
Google Scholar
3. Kataoka S, Hori A, Shirakawa T, Hirose G. Paramedian pontine infarction. Stroke (1997) 28(4):809–15. doi:10.1161/01.STR.28.4.809
CrossRef Full Text | Google Scholar
4. Furutani Y, Hata M, Miyamoto K, Moribata Y, Yoshimura N. A case of neuromyelitis optica masquerading as Miller Fisher syndrome. Case Rep Neurol (2014) 6(3):226–31. doi:10.1159/000368183
PubMed Abstract | CrossRef Full Text | Google Scholar
5. Ng AW, Teoh SC. Dengue eye disease. Surv Ophthalmol (2015) 60(2):106–14. doi:10.1016/j.survophthal.2014.07.003
PubMed Abstract | CrossRef Full Text | Google Scholar
6. Koehler PJ, Wattendorff AR, Goor C, Hekster REM, Falke THM. Bilateral horizontal gaze paralysis due to pontine hemorrhage. Clin Neurol Neurosurg (1986) 88(2):121–5. doi:10.1016/S0303-8467(86)80007-5
CrossRef Full Text | Google Scholar
7. Pierrot-Deseilligny C, Goasguen J, Chain F, Lapresle J. Pontine metastasis with dissociated bilateral horizontal gaze paralysis. J Neurol Neurosurg Psychiatry (1984) 47(2):159–64. doi:10.1136/jnnp.47.2.159
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Henderson S. A young patient with visual disturbance. Eur J Intern Med (2014) 25(6):e69–70. doi:10.1016/j.ejim.2014.05.007
CrossRef Full Text | Google Scholar
9. Matsui TA, Mineta H, Shioyama S, Kihara M, Takahashi M. . Clin Neurol (1998) 38(2):150–3.
Google Scholar
10. Bickerstaff ER. Brain-stem encephalitis; further observations on a grave syndrome with benign prognosis. Br Med J (1957) 1(5032):1384–7. doi:10.1136/bmj.1.5032.1384
CrossRef Full Text | Google Scholar
11. Schaefer PW, Grant PE, Gonzalez RG. Diffusion-weighted MR imaging of the brain. Radiology (2000) 217(2):331–45. doi:10.1148/radiology.217.2.r00nv24331
CrossRef Full Text | Google Scholar
12. Küker W, Ruff J, Gaertner S, Mehnert F, Mader I, Nägele T. Modern MRI tools for the characterization of acute demyelinating lesions: value of chemical shift and diffusion-weighted imaging. Neuroradiology (2004) 46(6):421-6. doi:10.1007/s00234-004-1203-5
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Kipfer S, Crook DW. Parálisis de la mirada horizontal bilateral aislada como primera manifestación de la esclerosis múltiple. Mult Scler J (2014) 20(6):754-5. doi:10.1177/1352458513518627
CrossRef Full Text | Google Scholar
14. Bronstein AM, Rudge P, Gresty MA, Du Boulay G, Morris J. Anomalías de la mirada horizontal. Hallazgos clínicos, oculográficos y de resonancia magnética. II. Parálisis de la mirada y oftalmoplejía internuclear. J Neurol Neurosurg Psychiatry (1990) 53(3):200–7. doi:10.1136/jnnp.53.3.200
CrossRef Full Text | Google Scholar
15. Wingerchuk DM, Lennon VA, Pittock SJ, Lucchinetti CF, Weinshenker BG. Revised diagnostic criteria for neuromyelitis optica. Neurology (2006) 66(10):1485–9. doi:10.1212/01.wnl.0000216139.44259.74
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Wingerchuk DM, Banwell B, Bennett JL, Cabre P, Carroll W, Chitnis T, et al. International consensus diagnostic criteria for neuromyelitis optica spectrum disorders. Neurology (2015) 85:177–89. doi:10.1212/WNL.0000000000001729
CrossRef Full Text | Google Scholar
17. Kira J. The expanding phenotype of CLIPPERS: is it a disease or a syndrome? J Neurol Neurosurg Psychiatry (2012) 83(1):2–3. doi:10.1136/jnnp-2011-301626
CrossRef Full Text | Google Scholar
18. Henn V, Lang W, Hepp K, Reisine H. Experimental gaze palsies in monkeys and their relation to human pathology. Brain (1984) 107(2):619–36. doi:10.1093/brain/107.2.619
PubMed Abstract | CrossRef Full Text | Google Scholar
19. Büttner-Ennever JA, Buttner U. A cell group associated with vertical eye movements in the rostral mesencephalic reticular formation of the monkey. Brain Res (1978) 151(1):31–47. doi:10.1016/0006-8993(78)90948-4
PubMed Abstract | CrossRef Full Text | Google Scholar
20. Horn AKE. The reticular formation. Prog Brain Res (2006) 151:127–55. doi:10.1016/S0079-6123(05)51005-7
CrossRef Full Text | Google Scholar
21. Nakao S, Shiraishi Y, Oda H, Inagaki M. Direct inhibitory projection of pontine omnipause neurons to burst neurons in the Forel’s field H controlling vertical eye movement-related motoneurons in the cat. Exp Brain Res (1988) 70(3):632–6. doi:10.1007
CrossRef Full Text | Google Scholar
22. Bender MB. Brain control of conjugate horizontal and vertical eye movements: a survey of the structural and functional correlates. Brain (1980) 103(1):23–69. doi:10.1093/brain/103.1.23
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Ranalli PJ, Sharpe JA. Vertical vestibulo-ocular reflex, smooth pursuit and eye-head tracking dysfunction in internuclear ophthalmoplegia. Brain (1988) 111(Pt 6):1299–317.
PubMed Abstract | Google Scholar
24. Bhidayasiri R, Plant GT, Leigh RJ. A hypothetical scheme for the brainstem control of vertical gaze. Neurology (2000) 54(10):1985–93.
PubMed Abstract | Google Scholar