H2S Lewis Structure, Molecular Geometry, Hybridization and Polarity
Hydrogen Sulfide is a common chemical compound that is useful for analyzing inorganic compounds of metal ions. It has the chemical formula of H2S. The molecule has two Hydrogen atoms and a single Sulfur atom. H2S is also a precursor for elemental Sulfur. It also plays a vital role in signaling pathways in the human body. So to understand the hybridization, polarity, and molecular geometry of this compound, it is essential to know its Lewis structure.
| Name of molecule | Hydrogen Disulfide ( H2S) |
| No of Valence Electrons in the molecule | 8 |
| Hybridization of CO2 | sp3 hybridization |
| Bond Angles | 104.5 degrees |
| Molecular Geometry of CO2 | Bent |
Before knowing its Lewis structure, let us calculate the total number of valence electrons in Hydrogen Sulfide as these electrons participate in bond formation and help us study Lewis structure with ease.
Contents
Valence electrons of H2S
To know the total number of valence electrons in Hydrogen Sulfide we need to add the valence electrons of both Hydrogen and Sulfur atoms. There are two atoms of Hydrogen and a single atom of Sulfur in the compound.
Each Hydrogen atom has only one electron which is also its valence electron
Hence there are two valence electrons for Hydrogen atom ( as there are two Hydrogen atoms)
Sulfur has six valence electrons.
Total number of valence electrons in H2S
= 2(1) + 6
= 8
Thus, there are a total of eight valence electrons in H2S.
Estructura de Lewis del H2S
La estructura de Lewis de cualquier compuesto es una representación estructural de los electrones de valencia que participan en la formación del enlace junto con los pares de electrones no enlazantes. Conocer la estructura de Lewis de un determinado compuesto químico es esencial ya que proporciona la información necesaria sobre el resto de propiedades químicas del compuesto.
La representación se muestra utilizando puntos y líneas que representan electrones. Los puntos representan los electrones que no participan en la formación del enlace. Mientras que las líneas representan los enlaces en el compuesto. La estructura se hace en base a la Regla del Octeto. La Regla del Octeto de la química establece que debe haber ocho electrones en la capa exterior de un elemento para que sea estable.
La Estructura de Lewis del Sulfuro de Hidrógeno es fácil de dibujar y entender. En este compuesto, los dos átomos de hidrógeno necesitan un electrón para realizar el enlace covalente con el Azufre. La estructura de Lewis del H2S es similar a la del H2S. El azufre necesita ocho electrones para cumplir los requisitos de la regla del octeto. Pero el Hidrógeno sólo necesita un único electrón para ser estable ya que pertenece a los elementos del Grupo 1.
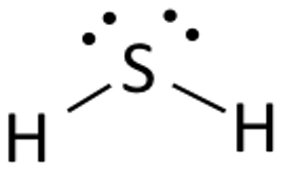
Coloca el átomo de Azufre en el centro y ordena sus electrones de valencia a su alrededor.
Ahora coloca dos átomos de Hidrógeno a ambos lados del átomo central.
Aquí los electrones de valencia del Azufre se utilizan para hacer estable al Hidrógeno donando un electrón a los dos átomos de Hidrógeno. Dos de los seis electrones de valencia participan en la formación del enlace.
Dibuja líneas ( para mostrar los enlaces) entre los átomos de Hidrógeno y Azufre.
Los cuatro electrones restantes son electrones no enlazantes y por lo tanto se muestran como puntos cerca del átomo de Azufre. En total hay dos pares de electrones no enlazantes en este compuesto y los átomos de Hidrógeno tienen una capa de valencia completa.
Hibridación del H2S
Para entender la hibridación del H2S, es vital conocer primero dos cosas:
- El número de enlaces en el compuesto y su tipo
Es imprescindible conocer el tipo de enlace en el compuesto para conocer su hibridación. En la molécula de H2S, dos átomos de Hidrógeno forman un enlace con el átomo central de Azufre. En la molécula se forman dos enlaces simples. Estos enlaces ocupan cuatro electrones de valencia, por lo que quedan otros cuatro electrones de valencia. Al formar el enlace, el orbital s del átomo de hidrógeno se solapa con el orbital p del átomo de azufre. El par solitario de electrones ocupa dos de los orbitales sp3. Los otros dos orbitales de sp3 se solapan con el orbital 1s del átomo de Hidrógeno.
Esta disposición conduce a la hibridación sp3 de la molécula de H2S. La superposición de los dos orbitales híbridos forma dos enlaces sigma entre el átomo de Hidrógeno y el de Azufre.
- El número estérico del compuesto dado
El número estérico se define como la región de densidad de electrones que se observa alrededor del átomo central. En este caso, como el azufre es el átomo central el número estérico del compuesto será el total acumulado de átomos unidos al átomo central y el número de pares solitarios de electrones alrededor del átomo central.
La fórmula para hallar este número es:
Número Estérico (SN)
= Nº de enlaces sigma en el átomo central +Nº de pares solitarios pi en el átomo central
En este caso de las moléculas de H2S, hay dos enlaces sigma, y hay dos pares solitarios de electrones en el átomo central.

Así el SN de la molécula de H2S = 2+2
=4
Como el número estérico del H2S es cuatro, tiene dos
orbitales híbridos y dos pares de electrones solitarios que la convierten en una hibridación sp3.
Ahora que conocemos la estructura de Lewis y la hibridación de la molécula, es fácil determinar su geometría molecular.
Geometría molecular del H2S
La hibridación de la molécula dada H2S es sp3; el átomo de Azufre está en enlace central con dos átomos de Hidrógeno formando el ángulo de enlace menos de 180 grados. Según la teoría VSEPR, los pares solitarios de electrones se repelen, pero como el átomo de Azufre es menos electronegativo, el ángulo de enlace disminuye a 104,5 grados.
Esta disminución del ángulo conduce a una estructura doblada.
Otra forma de conocer la geometría molecular es mediante el método AXN. Donde A denota el átomo central, X es para el par de electrones enlazados y N es para el par de electrones solitarios. Aquí la fórmula general será AX2N2 debido a los dos pares de electrones enlazados y los dos pares solitarios. Así, esta molécula muestra una geometría doblada.
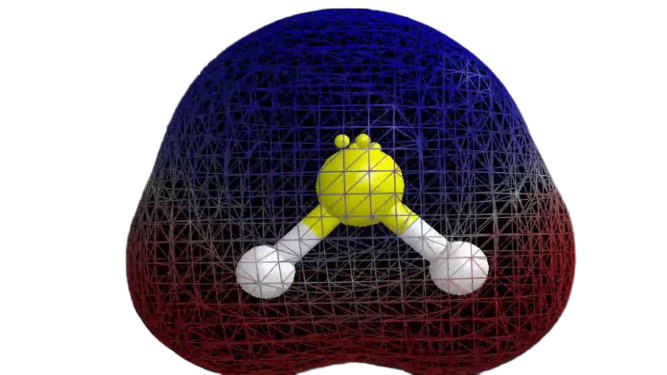
Polaridad del H2S
Ahora que tenemos la información necesaria sobre la molécula, es fácil determinar su polaridad. La polaridad de cualquier molécula depende de su geometría molecular y de la electronegatividad global. Como el átomo de azufre es menos electronegativo, la electronegatividad global del compuesto es inferior a 0,4, lo que lo hace no polar.
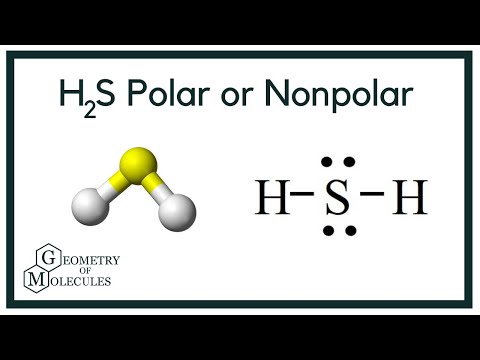
Por lo tanto, se puede decir que la molécula de H2S es no polar.
Observaciones finales
A partir de la información anterior, se puede concluir que la molécula de H2S tiene ocho electrones de valencia, hibridación sp3, geometría molecular doblada y es no polar.