Las primeras ideas sobre la materia: De Demócrito a Dalton
La teoría atómica moderna

Priestley, Lavoisier y otros habían sentado las bases del campo de la química. Sus experimentos demostraron que algunas sustancias podían combinarse con otras para formar nuevos materiales, que otras sustancias podían descomponerse para formar otras más simples y que unos pocos «elementos» clave no podían descomponerse más. Pero, ¿qué podía explicar este complejo conjunto de observaciones? John Dalton, un excepcional profesor y científico británico, reunió las piezas y desarrolló la primera teoría atómica moderna en 1803. Para saber más sobre los experimentos de Priestley y Lavoisier y cómo formaron la base de las teorías de Dalton, pruebe el experimento interactivo Dalton’s Playhouse, enlazado a continuación.
Dalton tenía la costumbre de seguir y registrar el tiempo en su ciudad natal de Manchester, Inglaterra. A través de sus observaciones de la niebla matutina y otros patrones meteorológicos, Dalton se dio cuenta de que el agua podía existir como un gas que se mezclaba con el aire y ocupaba el mismo espacio que éste. Los sólidos no podían ocupar el mismo espacio que los demás; por ejemplo, el hielo no podía mezclarse con el aire. Entonces, ¿qué podía permitir que el agua se comportara a veces como un sólido y a veces como un gas? Dalton se dio cuenta de que toda la materia debía estar compuesta por partículas diminutas. En estado gaseoso, esas partículas flotaban libremente y podían mezclarse con otros gases, como había propuesto Bernoulli. Pero Dalton amplió esta idea para aplicarla a toda la materia: gases, sólidos y líquidos. Dalton propuso por primera vez parte de su teoría atómica en 1803 y más tarde refinó estos conceptos en su clásico documento de 1808 Un nuevo sistema de filosofía química (al que puede acceder a través de un enlace en la pestaña Recursos).
La teoría de Dalton tenía cuatro conceptos principales:
- Toda la materia está compuesta por partículas indivisibles llamadas átomos. Bernoulli, Dalton y otros imaginaron los átomos como diminutas partículas parecidas a bolas de billar en varios estados de movimiento. Aunque este concepto es útil para ayudarnos a entender los átomos, no es correcto como veremos en módulos posteriores sobre teoría atómica enlazados al final de este módulo.
-
Todos los átomos de un elemento determinado son idénticos; los átomos de elementos diferentes tienen propiedades diferentes. La teoría de Dalton sugería que cada átomo de un elemento como el oxígeno es idéntico a cualquier otro átomo de oxígeno; además, los átomos de elementos diferentes, como el oxígeno y el mercurio, son diferentes entre sí. Dalton caracterizó los elementos según su peso atómico; sin embargo, cuando se descubrieron los isótopos de los elementos a finales de 1800, este concepto cambió.
-
Las reacciones químicas implican la combinación de átomos, no la destrucción de átomos. Los átomos son indestructibles e inmutables, por lo que los compuestos, como el agua y el cáliz de mercurio, se forman cuando un átomo se combina químicamente con otros átomos. Este era un concepto extremadamente avanzado para su época; aunque la teoría de Dalton implicaba que los átomos se unían entre sí, pasarían más de 100 años antes de que los científicos comenzaran a explicar el concepto de enlace químico.
-
Cuando los elementos reaccionan para formar compuestos, lo hacen en proporciones definidas y con números enteros. Los experimentos que Dalton y otros llevaron a cabo demostraron que las reacciones no son eventos aleatorios; proceden según fórmulas precisas y bien definidas. Este importante concepto de la química se analiza con más detalle a continuación.
Un elemento está formado por
Algunos de los detalles de la teoría atómica de Dalton requieren más explicación.
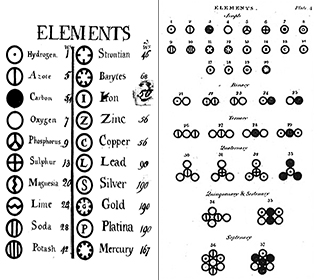
Elementos: Ya en 1660, Robert Boyle reconoció que la definición griega de elemento (tierra, fuego, aire y agua) no era correcta. Boyle propuso una nueva definición de elemento como sustancia fundamental, y ahora definimos los elementos como sustancias fundamentales que no pueden descomponerse más por medios químicos. Los elementos son los bloques de construcción del universo. Son sustancias puras que forman la base de todos los materiales que nos rodean. Algunos elementos pueden verse en estado puro, como el mercurio en un termómetro; otros los vemos principalmente en combinación química con otros, como el oxígeno y el hidrógeno en el agua. En la actualidad conocemos aproximadamente 116 elementos diferentes. Cada uno de los elementos recibe un nombre y una abreviatura de una o dos letras. A menudo esta abreviatura es simplemente la primera letra del elemento; por ejemplo, el hidrógeno se abrevia como H, y el oxígeno como O. A veces un elemento recibe una abreviatura de dos letras; por ejemplo, el helio es He. Cuando se escribe la abreviatura de un elemento, la primera letra siempre va en mayúscula y la segunda (si la hay) siempre va en minúscula.
Atomos: Una unidad de un elemento se llama átomo. El átomo es la unidad más básica de la materia, que constituye todo lo que hay en el mundo que nos rodea. Cada átomo conserva todas las propiedades químicas y físicas de su elemento madre. A finales del siglo XIX, los científicos demostrarían que los átomos estaban formados en realidad por piezas más pequeñas, «subatómicas», lo que echó por tierra el concepto de bola de billar del átomo (véase nuestro módulo Teoría atómica I: Los primeros días).
Compuestos: La mayoría de los materiales con los que entramos en contacto son compuestos, sustancias formadas por la combinación química de dos o más átomos de los elementos. Una sola «partícula» de un compuesto se llama molécula. Dalton imaginó incorrectamente que los átomos se «enganchaban» para formar moléculas. Sin embargo, Dalton se dio cuenta correctamente de que los compuestos tienen fórmulas precisas. El agua, por ejemplo, siempre está formada por dos partes de hidrógeno y una de oxígeno. La fórmula química de un compuesto se escribe enumerando los símbolos de los elementos juntos, sin espacios entre ellos. Si una molécula contiene más de un átomo de un elemento, se pone un número después del símbolo para indicar el número de átomos de ese elemento en la molécula. Así, la fórmula del agua es H2O, nunca HO o H2O2.
Comprehension Checkpoint
The formula for water can be written as either H2O or HO2.