Proyectos de ciencias para principiantes: Química
Química
Sal o azúcar: Qué se disuelve más rápido en diferentes líquidos
Las disoluciones no son más que mezclas de diferentes compuestos o elementos. Te encuentras con soluciones todos los días sin darte cuenta.
Incluso el aire que respiras… que contiene agua… es una solución de un líquido y un gas. Si hoy has bebido un refresco, en realidad has bebido una solución de un gas disuelto en agua aromatizada. Si llevas una pulsera de plata de ley, llevas una solución de dos metales.
En este experimento, trabajarás con una solución líquida, que es uno de los tres tipos de soluciones. Los otros tipos son las soluciones gaseosas y las soluciones sólidas.
¿Entonces cuál parece ser el problema?
Un soluto es la sustancia?ya sea un sólido, un líquido o un gas?que se disuelve. Un disolvente, que también puede ser un sólido, un líquido o un gas, es la sustancia que realiza la disolución. Una solución es una mezcla uniforme de un soluto (normalmente un sólido) disuelto en un disolvente (normalmente un líquido).
Cuando remueves una cucharada de azúcar en un vaso de agua, estás formando una solución. Este tipo de solución líquida está compuesta por un soluto sólido, que es el azúcar, y un disolvente líquido, que es el agua. A medida que las moléculas de azúcar se extienden uniformemente por el agua, el azúcar se disuelve.
Al mezclar un líquido en un gas se forma otro tipo de solución, llamada solución gaseosa. Un ejemplo de este tipo de solución es la humedad. La humedad es agua (un líquido) disuelta en aire (un gas).
Piensa en cómo se disuelve un terrón de azúcar en el agua, en comparación con un paquete de azúcar suelto. El terrón se disuelve más lentamente porque inicialmente hay menos moléculas de azúcar en contacto con el agua.
En una solución sólida, como la plata de ley, el cobre que se ha calentado a altas temperaturas se mezcla con la plata que también se ha calentado hasta que se funde. El cobre es el soluto, que es la sustancia que se disolverá en el disolvente. La plata es el disolvente.
El tipo de solución viene determinado por el estado de la materia del disolvente. Si la sustancia que se disuelve es un líquido, la solución se llama solución líquida. Si el disolvente es un gas, la solución se denomina solución gaseosa. Y has acertado: Un disolvente sólido formará una disolución sólida.
Puedes comprobar el tamaño de los cristales de sal y azúcar con un microscopio o una lupa, lo que te permitirá ver también sus formas. Si dibujas lo que ves, usando un lápiz para poder ilustrar el sombreado, podrías incluir la ilustración como parte de la exposición final de tu proyecto de feria de ciencias.
Hay algunos factores que generalmente aumentan la cantidad de soluto que se puede disolver. Si quieres disolver más azúcar en la misma cantidad de agua, por ejemplo, puedes calentar el agua. También puedes moler el azúcar en partículas más pequeñas para aumentar su superficie, o puedes remover la mezcla.
En los años que llevas usando sal y azúcar en tus comidas, probablemente hayas notado que cada trozo de sal?que en realidad es un cristal… es un poco más pequeño que cada trozo de azúcar, que también es un cristal.
Una molécula son dos o más elementos que se combinan químicamente. Una molécula de sal contiene sodio y cloro, que se combinan químicamente para formar cloruro de sodio. La fórmula química de esta sal es NaCl. Una molécula de azúcar contiene carbono, hidrógeno y oxígeno. La fórmula química del azúcar es C12H22O11.
El problema que intentarás resolver en este experimento es si el azúcar o la sal se disuelven más rápido cuando se mezclan en varios líquidos. ¿Afecta el tamaño de los trozos a la rapidez con la que se mezclan con el líquido?
Cuando disuelves azúcar o sal en un líquido… digamos, agua… lo que ocurre es que las moléculas de azúcar se mueven para encajarse entre las moléculas de agua dentro de un vaso de precipitados. La siguiente ilustración muestra cómo se disponen las diferentes moléculas en el recipiente.
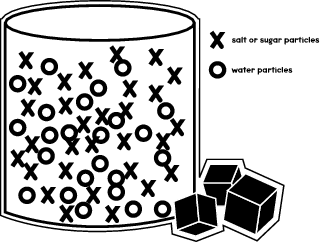
En tu experimento, verás cómo las moléculas de sal y azúcar se mueven dentro de diferentes líquidos y se disuelven a diferentes velocidades.
El título de esta sección, «Sal o azúcar: ¿Qué se disuelve más rápido en diferentes líquidos?» podría servir como título de tu proyecto, si lo deseas. También podrías considerar uno de los siguientes títulos para tu proyecto:
- El Gran Concurso de Disolución de Sal vs. Azúcar
- Usando la Sal y el Azúcar para Explorar Cómo se Disuelven las Sustancias
- White vinegar
- Club soda
- Ginger ale
- Glass cleaner (such as Windex)
- Lemonade
- Tea or iced tea (each at room temperature)
- Apple juice
- Rubbing alcohol
- 12 clear, plastic cups (10 ounce )
- One permanent marker
- One (1 teaspoon) (5.0 ml) measuring spoon
- One (12 teaspoon) (2.5 ml) measuring spoon
- One (1 cup) (240 ml) measuring cup
- 8 teaspoons (40 ml) salt, divided in 16 (12 teaspoon) portions
- 8 teaspoons (40 ml) sugar, divided in 16 (12 teaspoon) portions
- 48 ounces (1,440 ml) water at room temperature
- 24 ounces (720 ml) each of five different, clear liquids, all at room temperature
- One clock or watch with a second hand
- One clear plastic cup containing eight fluid ounces (240 ml) water at room temperature
- Con el rotulador permanente, escribe «sal» en seis de los vasos de plástico, y «azúcar» en los otros seis.
- Coloca 1/2 cucharadita (2,5 ml) de sal en cada uno de los seis vasos etiquetados como «sal».
- Coloca 1/2 cucharadita (2,5 ml) de azúcar en cada uno de los seis vasos etiquetados como «azúcar».
- Añadir 8 onzas (240 ml) de agua a una de las tazas que contiene la sal, y a otra que contiene el azúcar. Registre inmediatamente el momento en que se agregó el agua en una tabla de datos similar a la que se muestra en la siguiente sección, «Seguimiento de su experimento».
- Observa cómo se disuelven los solutos (sal y azúcar) en el disolvente (agua). Anota en la tabla de datos el tiempo en el que te parece que cada soluto se ha disuelto completamente. Estos tiempos probablemente no serán los mismos.
- Calcule el tiempo transcurrido durante el cual se produjo la disolución. Toma el momento en el que se añadió el agua a los vasos y comenzó la disolución, y réstalo del momento en el que terminó la disolución. Esto te da el total de minutos que tardaron la sal y el azúcar en disolverse completamente en el líquido.
- Repite los pasos 4 a 6, utilizando cada líquido diferente en lugar del agua.
- Lava, aclara y seca bien cada una de las 12 tazas.
- Repita los pasos 2 a 8 dos veces más, para un total de tres ensayos para cada uno de los seis líquidos.
- Calcule un tiempo medio de disolución para la sal y el azúcar en cada uno de los seis líquidos.
- Aumentar o disminuir la temperatura del disolvente
- Aumentar la superficie del soluto
- Agitar
Cualquier nombre que elijas está bien. Dediquemos ahora un minuto a considerar por qué este proyecto es un valioso uso de tu tiempo.
¿Cuál es el objetivo?
Cuando hay un amplio espacio entre las moléculas de un disolvente, se dice que éste es insaturado. Cuando una gran cantidad de soluto se ha disuelto en el disolvente, pero todavía hay algo de espacio entre las moléculas, la solución es concentrada. Cuando no se puede disolver absolutamente más soluto dentro de un disolvente, la solución está saturada.
Y cuando el exceso de soluto se ha disuelto calentando la solución, se dice que está sobresaturada.
El objetivo de este experimento, además de aprender si la sal o el azúcar se disuelven más rápido en distintos líquidos, es aprender cómo interactúan las moléculas en una solución.
Como has visto en la ilustración anterior, las moléculas de agua ocupan la mayor parte del espacio del recipiente. Pero aún queda algo de espacio disponible en el que pueden caber las moléculas de azúcar o de sal. A través de tu experimento, aprenderás lo rápido que caben las moléculas de azúcar en esos espacios, en comparación con las partículas de sal.
Saber esto te ayudará a entender mejor el proceso que ocurre cuando una sustancia se disuelve.
El control en tu experimento será el agua. Los otros líquidos en los que disolverás la sal y el azúcar serán las variables.
| Controles: | ¿Disolvente?agua |
| ¿Solutos?azúcar, sal | Variables: | Cinco líquidos claros diferentes (pueden ser de color) |