Química para no iniciados
Objetivos de aprendizaje
- Definir el radio atómico.
- Describir cómo cambia el atómico dentro de un período.
- Describir cómo cambia el radio atómico dentro de un grupo.
¿Cómo puede caber toda esta gente en un espacio tan pequeño?
 Los eventos atraen a un gran número de personas. Incluso un evento al aire libre puede llenarse de tal manera que no haya espacio para más gente. La capacidad de la multitud depende de la cantidad de espacio en el lugar, y la cantidad de espacio depende del tamaño de los objetos que lo llenan. Podemos meter más personas en un espacio determinado que elefantes, porque los elefantes son más grandes que las personas. Por la misma razón, podemos meter más ardillas en ese mismo espacio que personas. Conocer el tamaño de los objetos con los que tratamos puede ser importante para decidir cuánto espacio se necesita.
Los eventos atraen a un gran número de personas. Incluso un evento al aire libre puede llenarse de tal manera que no haya espacio para más gente. La capacidad de la multitud depende de la cantidad de espacio en el lugar, y la cantidad de espacio depende del tamaño de los objetos que lo llenan. Podemos meter más personas en un espacio determinado que elefantes, porque los elefantes son más grandes que las personas. Por la misma razón, podemos meter más ardillas en ese mismo espacio que personas. Conocer el tamaño de los objetos con los que tratamos puede ser importante para decidir cuánto espacio se necesita.
El tamaño de los átomos es importante cuando se intenta explicar el comportamiento de los átomos o compuestos. Una de las formas en que podemos expresar el tamaño de los átomos es con el radio atómico . Este dato nos ayuda a entender por qué algunas moléculas encajan entre sí y por qué otras tienen partes que se apelmazan demasiado bajo ciertas condiciones.
El tamaño de un átomo se define por el borde de su orbital. Sin embargo, los límites de los orbitales son difusos y, de hecho, son variables bajo diferentes condiciones. Para estandarizar la medición de los radios atómicos, se mide la distancia entre los núcleos de dos átomos idénticos unidos. El radio atómico se define como la mitad de la distancia entre los núcleos de átomos idénticos unidos entre sí.

Figura 1. El radio atómico (r) de un átomo puede definirse como la mitad de la distancia (d) entre dos núcleos en una molécula diatómica.
Se han medido los radios atómicos de los elementos. Las unidades para los radios atómicos son los picómetros, que equivalen a 10-12 metros. Como ejemplo, la distancia internuclear entre los dos átomos de hidrógeno de una molécula de H2 se mide en 74 pm. Por lo tanto, el radio atómico de un átomo de hidrógeno es \frac{74}{2}=37\text{}.
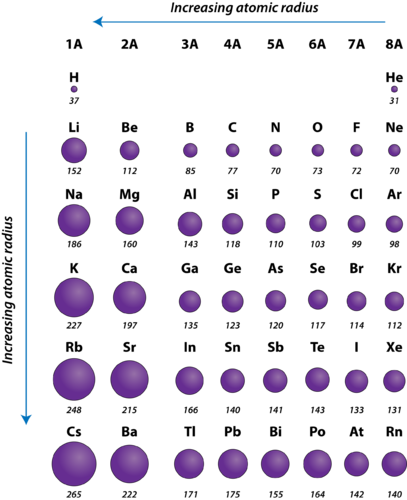
Figura 2. Radios atómicos de los elementos representativos medidos en picómetros.
Tendencia periódica
El radio atómico de los átomos generalmente disminuye de izquierda a derecha a lo largo de un período. Hay algunas pequeñas excepciones, como que el radio del oxígeno es ligeramente mayor que el del nitrógeno. Dentro de un período, los protones se añaden al núcleo a medida que los electrones se añaden al mismo nivel de energía principal. Estos electrones se acercan gradualmente al núcleo debido a su mayor carga positiva. Como la fuerza de atracción entre los núcleos y los electrones aumenta, el tamaño de los átomos disminuye. El efecto disminuye a medida que uno se desplaza más a la derecha en un período debido a las repulsiones electrón-electrón que, de otro modo, harían que el tamaño del átomo aumentara.
Tendencia de grupo
El radio atómico de los átomos generalmente aumenta de arriba a abajo dentro de un grupo. A medida que el número atómico aumenta hacia abajo en un grupo, se produce de nuevo un aumento de la carga nuclear positiva. Sin embargo, también aumenta el número de niveles energéticos principales ocupados. Los niveles de energía principales más altos consisten en orbitales de mayor tamaño que los orbitales de los niveles de energía más bajos. El efecto del mayor número de niveles de energía principales compensa el aumento de la carga nuclear, por lo que el radio atómico aumenta hacia abajo en un grupo.

Figura 3. A graph of atomic radius plotted versus atomic number. Each successive period is shown in a different color. As the atomic number increases within a period, the atomic radius decreases.
Summary
- Atomic radius is determined as the distance between the nuclei of two identical atoms bonded together.
- The atomic radius of atoms generally decreases from left to right across a period.
- The atomic radius of atoms generally increases from top to bottom within a group.
Practice
Use the link below to answer the following questions:
http://chemwiki.ucdavis.edu/Inorganic_Chemistry/Descriptive_Chemistry/Periodic_Table_of_the_Elements/Atomic_Radi
- What influences the atomic size of an atom?
- What is a covalent radius?
- What is an ionic radius?
Review
- Define «atomic radius.»
- What are the units for measurement of atomic radius?
- How does the atomic radius change across a period?
- How does atomic radius change from top to bottom within a group?
- Explain why the atomic radius of hydrogen is so much smaller that the atomic radius for potassium.