10.13 : Hypothèse d’Avogadro et volume molaire
Hypothèse d’Avogadro et volume molaire
Le volume est une troisième façon de mesurer la quantité de matière, après le nombre d’éléments et la masse. Avec les liquides et les solides, le volume varie fortement en fonction de la densité de la substance. Cela s’explique par le fait que les particules solides et liquides sont serrées les unes contre les autres, avec très peu d’espace entre les particules. En revanche, les gaz sont en grande partie composés d’espaces vides entre les particules de gaz proprement dites (voir figure ci-dessous).
En 1811, Amadeo Avogadro explique que les volumes de tous les gaz peuvent être facilement déterminés. L’hypothèse d’Avogadro stipule que des volumes égaux de tous les gaz à la même température et à la même pression contiennent un nombre égal de particules. Étant donné que le volume total qu’un gaz occupe est principalement constitué de l’espace vide entre les particules, la taille réelle des particules elles-mêmes est presque négligeable. Un volume donné d’un gaz contenant de petites particules légères comme l’hydrogène \(\left( \ce{H_2} \right)\) contient le même nombre de particules que le même volume d’un gaz lourd contenant de grosses particules comme l’hexafluorure de soufre, \(\ce{SF_6}\).
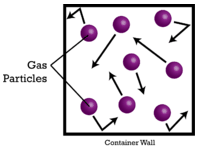
Les gaz sont compressibles, ce qui signifie que lorsqu’ils sont soumis à une pression élevée, les particules sont forcées de se rapprocher les unes des autres. Cela diminue la quantité d’espace vide et réduit le volume du gaz. Le volume des gaz est également affecté par la température. Lorsqu’un gaz est chauffé, ses molécules se déplacent plus rapidement et le gaz se dilate. En raison de la variation du volume des gaz due aux changements de pression et de température, la comparaison des volumes de gaz doit être effectuée à une température et une pression standard. La température et la pression standard (STP) sont définies comme suit : \(0^\text{o} \text{C}\) \(\left( 273,15 \ : \text{K} \right)\) et \(1 \ : \text{atm}\) pression. Le volume molaire d’un gaz est le volume d’une mole d’un gaz à STP. À STP, une mole (\( 6,02 \times 10^{23}\) particules représentatives) d’un gaz quelconque occupe un volume de \(22,4 \ : \text{L}\) (figure ci-dessous).

La figure ci-dessous illustre comment le volume molaire peut être vu en comparant différents gaz. Des échantillons d’hélium \(\left( \ce{He} \right)\), d’azote \(\left( \ce{N_2} \right)\), et de méthane \(\left( \ce{CH_4} \right)\) sont à STP. Chacun d’entre eux contient 1 mole ou \(6,02 \times 10^{23}\) particules. Cependant, la masse de chaque gaz est différente et correspond à la masse molaire de ce gaz : \(4,00 \ : \text{g/mol}\) pour \(\ce{He}\), \(28,0 \ : \text{g/mol}\) pour \(\ce{N_2}\), et \(16,0 \ : \text{g/mol}\) pour \(\ce{CH_4}\).