19.1: Polypeptides and Proteins
Learning Objectives
- Define or describe the following:
- amino acid
- « R » group
- peptide bond
- peptide
- polypeptide
- primary protein structure
- secondary protein structure
- tertiary protein structure
- quaternary protein structure
- gene
- Describe how the primary structure of a protein or polypeptide ultimately detemines its final three-dimensional shape.
- Describe how the order of nucleotide bases in DNA ultimately determines the final three-dimensional shape of a protein or polypeptide.
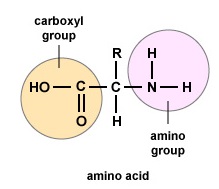
Amino acids are the building blocks for proteins. All amino acids contain an amino or NH2 group and a carboxyl (acid) or COOH group. There are 20 different amino acids commonly found in proteins and often 300 or more amino acids per protein molecule. Chaque acide aminé diffère par son groupe « R ». Le groupe « R » d’un acide aminé est le reste de la molécule, c’est-à-dire la partie autre que le groupe amino, le groupe acide et le carbone central. Chaque acide aminé différent possède un groupe « R » unique et les propriétés chimiques uniques d’un acide aminé dépendent de celle de son groupe « R » (figure \(\PageIndex{1}\)).
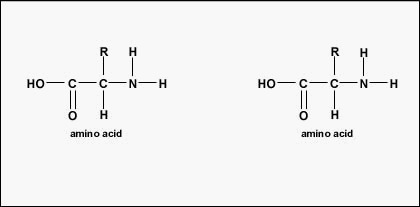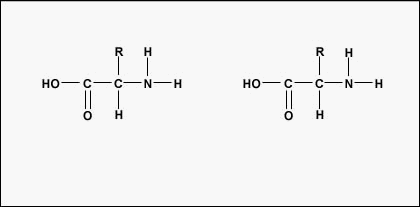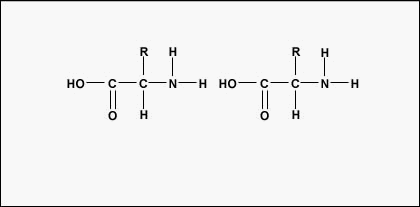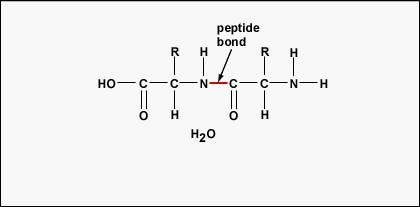
Pour former des polypeptides et des protéines, les acides aminés sont reliés entre eux par des liaisons peptidiques, dans lesquelles le groupe amino ou NH2 d’un acide aminé se lie au groupe carboxyle (acide) ou COOH d’un autre acide aminé, comme le montrent (la figure \(\PageIndex{2}\) et la figure \(\PageIndex{3}\)).
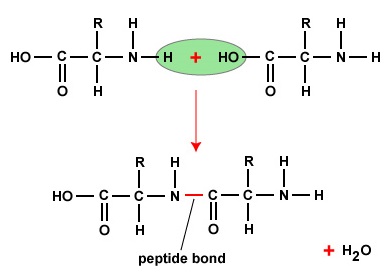
Un peptide est constitué de deux ou plusieurs acides aminés reliés entre eux par des liaisons peptidiques, et un polypeptide est une chaîne de nombreux acides aminés. Une protéine contient un ou plusieurs polypeptides. Les protéines sont donc de longues chaînes d’acides aminés maintenues ensemble par des liaisons peptidiques.
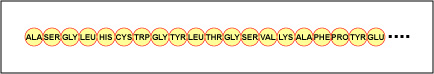
L’ordre réel des acides aminés dans la protéine est appelé sa structure primaire (figure \(\PageIndex{4}\)) et est déterminé par l’ADN. Comme nous le verrons plus tard dans cette unité, l’ADN est divisé en unités fonctionnelles appelées gènes. Un gène est une séquence de bases désoxyribonucléotidiques le long d’un brin d’ADN qui code pour un produit fonctionnel – une molécule spécifique d’ARN messager, d’ARN de transfert ou d’ARN ribosomique. Le produit est généralement l’ARN messager (ARNm) et l’ARNm aboutit finalement à la synthèse d’un polypeptide ou d’une protéine. Par conséquent, on dit couramment que l’ordre des bases désoxyribonucléotidiques dans un gène détermine la séquence d’acides aminés d’une protéine particulière. Comme certains acides aminés peuvent interagir avec d’autres acides aminés dans la même protéine, cette structure primaire détermine finalement la forme finale et donc les propriétés chimiques et physiques de la protéine.
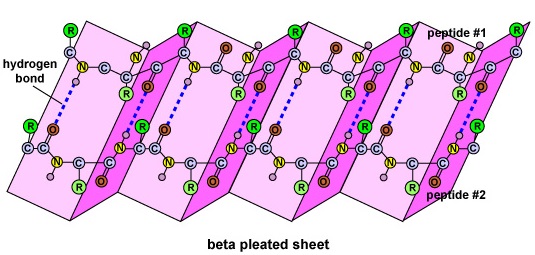
La structure secondaire de la protéine est due aux liaisons hydrogène qui se forment entre l’atome d’oxygène d’un acide aminé et l’atome d’azote d’un autre. Cela donne à la protéine ou au polypeptide la forme bidimensionnelle d’une hélice alpha ou d’un feuillet plissé bêta (Figure \(\PageIndex{5}\)).
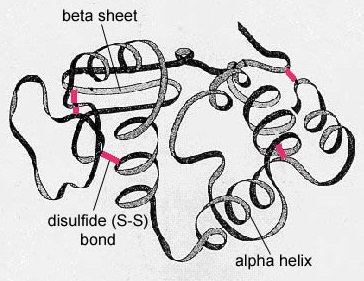
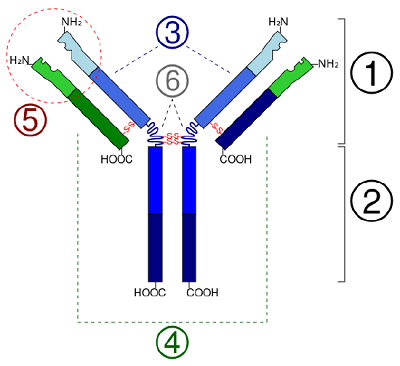
Dans les protéines globulaires comme les enzymes, la longue chaîne d’acides aminés se replie en une forme fonctionnelle tridimensionnelle ou structure tertiaire. Ceci est dû au fait que certains acides aminés avec des groupes sulfhydryle ou SH forment des liaisons disulfure (S-S) avec d’autres acides aminés dans la même chaîne. D’autres interactions entre les groupes R des acides aminés, comme les liaisons hydrogène, les liaisons ioniques, les liaisons covalentes et les interactions hydrophobes, contribuent également à la structure tertiaire (figure \(\PageIndex{6}\)). Dans certaines protéines, comme les molécules d’anticorps et l’hémoglobine, plusieurs polypeptides peuvent se lier pour former une structure quaternaire (figure \(\PageIndex{7}\)).
Comme nous le verrons plus loin dans cette unité, au cours de la synthèse des protéines, l’ordre des bases nucléotidiques le long d’un gène est transcrit en un brin complémentaire d’ARNm qui est ensuite traduit par l’ARNt dans l’ordre correct des acides aminés pour ce polypeptide ou cette protéine. Par conséquent, l’ordre des bases désoxyribonucléotidiques le long de l’ADN détermine l’ordre des acides aminés dans les protéines. Comme certains acides aminés peuvent interagir avec d’autres acides aminés, l’ordre des acides aminés de chaque protéine détermine sa forme tridimensionnelle finale, qui détermine à son tour la fonction de cette protéine (par ex, avec quel substrat une enzyme va réagir, avec quels épitopes le Fab d’un anticorps va se combiner, à quels récepteurs une cytokine va se lier).
Summary
- Les acides aminés sont les éléments constitutifs des protéines. Il existe 20 acides aminés différents que l’on trouve couramment dans les protéines et souvent 300 acides aminés ou plus par molécule de protéine.
- Tous les acides aminés contiennent un groupe amino ou NH2 et un groupe carboxyle (acide) ou COOH.
- Pour former des polypeptides et des protéines, les acides aminés sont reliés entre eux par des liaisons peptidiques, dans lesquelles le groupe amino ou NH2 d’un acide aminé se lie au groupe carboxyle (acide) ou COOH d’un autre acide aminé.
- Un peptide est constitué de deux ou plusieurs acides aminés reliés entre eux par des liaisons peptidiques ; un polypeptide est une chaîne de nombreux acides aminés ; et une protéine contient un ou plusieurs polypeptides. Par conséquent, les protéines sont de longues chaînes d’acides aminés maintenus ensemble par des liaisons peptidiques.
- L’ordre réel des acides aminés dans la protéine est appelé sa structure primaire et est déterminé par l’ADN.
- L’ordre des bases désoxyribonucléotidiques dans un gène détermine la séquence d’acides aminés d’une protéine particulière. Comme certains acides aminés peuvent interagir avec d’autres acides aminés dans la même protéine, cette structure primaire détermine finalement la forme finale et donc les propriétés chimiques et physiques de la protéine.
- La structure secondaire de la protéine est due aux liaisons hydrogène qui se forment entre l’atome d’oxygène d’un acide aminé et l’atome d’azote d’un autre et donne à la protéine ou au polypeptide la forme bidimensionnelle d’une hélice alpha ou d’un feuillet plissé bêta.
- Dans les protéines globulaires comme les enzymes, la longue chaîne d’acides aminés devient repliée en une forme fonctionnelle tridimensionnelle ou structure tertiaire. Ceci est dû au fait que certains acides aminés avec des groupes sulfhydryle ou SH forment des liaisons disulfure (S-S) avec d’autres acides aminés de la même chaîne. D’autres interactions entre les groupes R des acides aminés, comme les liaisons hydrogène, les liaisons ioniques, les liaisons covalentes et les interactions hydrophobes, contribuent également à la structure tertiaire.
- In some proteins, such as antibody molecules, several polypeptides may bond together to form a quaternary structure.
Contributors and Attributions
-
Dr. Gary Kaiser (COMMUNITY COLLEGE OF BALTIMORE COUNTY, CATONSVILLE CAMPUS)