2.3 : Familles et périodes du tableau périodique
Familles du tableau périodique
Rappellez-vous que Mendeleïev a organisé le tableau périodique de façon à ce que les éléments ayant les propriétés les plus similaires soient placés dans le même groupe. Un groupe est une colonne verticale du tableau périodique. Tous les éléments 1A ont un électron de valence. C’est ce qui fait que ces éléments réagissent de la même façon que les autres membres de la famille. Les éléments du groupe 1A sont tous très réactifs et forment des composés dans les mêmes proportions avec des propriétés similaires à celles des autres éléments. En raison de la similitude de leurs propriétés chimiques, Mendeleïev a placé ces éléments dans le même groupe. Le groupe 1A est également connu sous le nom de « métaux alcalins ». Bien que la plupart des métaux aient tendance à être très durs, ces métaux sont en fait mous et peuvent être facilement coupés.
Le groupe 2A est également appelé les métaux alcalino-terreux. Encore une fois, en raison de leurs similitudes dans les configurations électroniques, ces éléments ont des propriétés similaires les uns aux autres. Le même schéma s’applique aux autres groupes du tableau périodique. Rappelez-vous, Mendeleïev a disposé le tableau de façon à ce que les éléments ayant les propriétés les plus similaires soient dans le même groupe du tableau périodique.
Il est important de reconnaître quelques autres groupes importants du tableau périodique par leur nom de groupe. Les éléments du groupe 7A (ou 17) sont également appelés halogènes. Ce groupe contient des éléments non métalliques très réactifs.
Les gaz nobles font partie du groupe 8A. Ces éléments ont également des propriétés similaires les uns aux autres, la propriété la plus significative étant qu’ils sont extrêmement peu réactifs, formant rarement des composés. Nous en apprendrons la raison plus tard, lorsque nous discuterons de la formation des composés. Les éléments de ce groupe sont également des gaz à température ambiante.
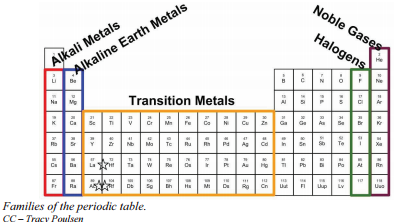
Un autre système de numérotation numérote tous les éléments du bloc \(s\), \(p\) et \(d\) de 1 à 18. Dans ce système de numérotation, le groupe 1A est le groupe 1 ; le groupe 2A est le groupe 2 ; les halogènes (7A) sont le groupe 17 ; et les gaz rares (8A) sont le groupe 18. Vous rencontrerez des tableaux périodiques avec les deux systèmes de numérotation. Il est important de reconnaître quel système de numérotation est utilisé et d’être capable de trouver le nombre d’électrons de valence dans les éléments du bloc principal, quel que soit le système de numérotation utilisé.