4. Bases fortes et faibles
Bases faibles
L’ammoniac est une base faible typique. L’ammoniac lui-même ne contient évidemment pas d’ions hydroxyde, mais il réagit avec l’eau pour produire des ions ammonium et des ions hydroxyde.
Cependant, la réaction est réversible, et à tout moment, environ 99 % de l’ammoniac est encore présent sous forme de molécules d’ammoniac. Seul environ 1 % a effectivement produit des ions hydroxyde. Une base faible est une base qui ne se transforme pas entièrement en ions hydroxyde en solution. Lorsqu’une base faible réagit avec l’eau, la position d’équilibre varie d’une base à l’autre. Plus elle est à gauche, plus la base est faible.
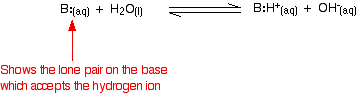
Vous pouvez obtenir une mesure de la position d’un équilibre en écrivant une constante d’équilibre pour la réaction. Plus la valeur de la constante est faible, plus l’équilibre se situe vers la gauche. Dans ce cas, la constante d’équilibre est appelée Kb. Elle est définie comme suit :
\}{}\]
The relationship between Kb and pKb is exactly the same as all the other « p » terms in this topic:
\
The table shows some values for \(K_b\) and \(pK_b\) for some weak bases.
| base | Kb (mol dm-3) | pKb |
|---|---|---|
| C6H5NH2 | 4.17 x 10-10 | 9.38 |
| NH3 | 1.78 x 10-5 | 4.75 |
| CH3NH2 | 4.37 x 10-4 | 3.36 |
| CH3CH2NH2 | 5.37 x 10-4 | 3.27 |