Adipocytes
Les adipocytes sont les principaux sites de stockage de l’énergie dans le corps, et ils ont également des fonctions endocriniennes critiques. Par conséquent, comprendre le développement et la fonction des adipocytes – en particulier à la lumière de la pandémie d’obésité – est essentiel pour comprendre l’homéostasie métabolique. Il existe deux catégories générales d’adipocytes : les adipocytes blancs, qui stockent l’énergie sous la forme d’une seule grosse gouttelette lipidique et ont d’importantes fonctions endocriniennes, et les adipocytes bruns, qui stockent l’énergie dans de multiples petites gouttelettes lipidiques, mais spécifiquement pour être utilisées comme combustible afin de générer de la chaleur corporelle (c’est-à-dire la thermogenèse). La production de chaleur par les adipocytes bruns est rendue possible par leur expression unique de la protéine de découplage 1 (Ucp1) localisée dans les mitochondries. Cependant, ces classifications sont trop simplifiées car certains adipocytes blancs peuvent adopter les caractéristiques des adipocytes bruns (appelés adipocytes brite ou beige) et vice versa en fonction de la température et du régime alimentaire. Nous souhaitons comprendre les origines des différents adipocytes et définir les voies de signalisation et métaboliques qui contrôlent leur développement, leur distribution et leur fonction.
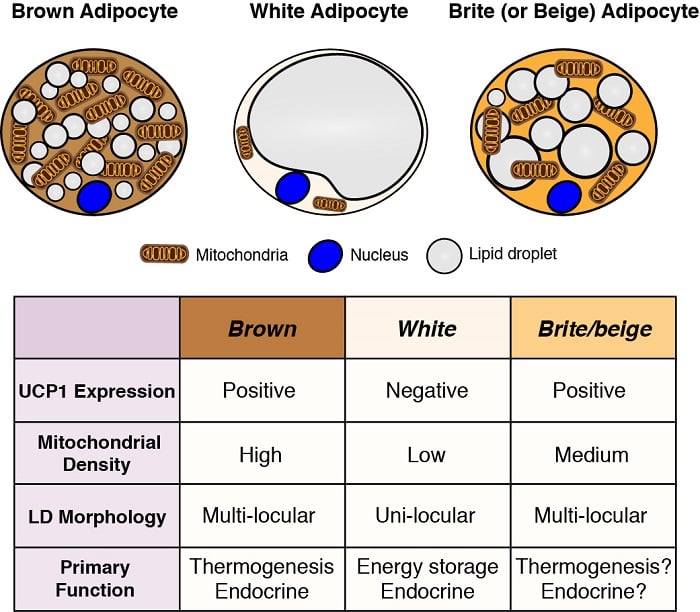
Origines des adipocytes
Pour comprendre le rôle du tissu adipeux dans la santé et la maladie, il est essentiel de comprendre comment il se développe, et à cet égard, l’un des domaines les moins bien compris de la biologie du tissu adipeux est l’origine développementale des différents types d’adipocytes. La définition de l’origine des adipocytes pourrait contribuer à expliquer les schémas de répartition des graisses corporelles, en particulier chez les personnes obèses ou lipodystrophiques, et pourrait fournir des indices sur les différences métaboliques observées entre certains dépôts de graisse. L’identification des cellules précurseurs d’adipocytes et des mécanismes régulant leur expansion est également essentielle pour comprendre et gérer la fonction saine du tissu adipeux. Il pourrait également être possible de concevoir le développement d’adipocytes « sains » (tels que les adipocytes bruns ou brite/beige) à partir de précurseurs pour des thérapies cellulaires visant essentiellement à combattre la graisse par la graisse. En utilisant une combinaison de stratégies de génétique et de traçage des lignées, nous avons précédemment cartographié les origines des adipocytes résidant dans différents dépôts. Nos résultats révèlent un niveau inattendu d’hétérogénéité compatible avec des adipocytes ayant des origines développementales multiples et soutenant un modèle dans lequel le destin des adipocytes dépend probablement de facteurs extrinsèques et intrinsèques.
Les adipocytes ont de multiples origines développementales
(en bas à gauche) Distribution anatomique des dépôts de tissu adipeux chez une souris. Les dépôts de tissu adipeux brun (BAT) et de tissu adipeux blanc (WAT) sont représentés. (ci-dessous à droite) Exemple d’une expérience de traçage de la lignée au cours de laquelle des cellules précurseurs du développement et toutes leurs descendantes ont été marquées de manière indélébile avec une marque fluorescente liée à l’expression de Myf5 (panneau a) ou de Pax3 (panneau b). Les adipocytes marqués en vert (mGFP) proviennent d’une cellule précurseur différente puis les adipocytes marqués en rouge (mTFP).
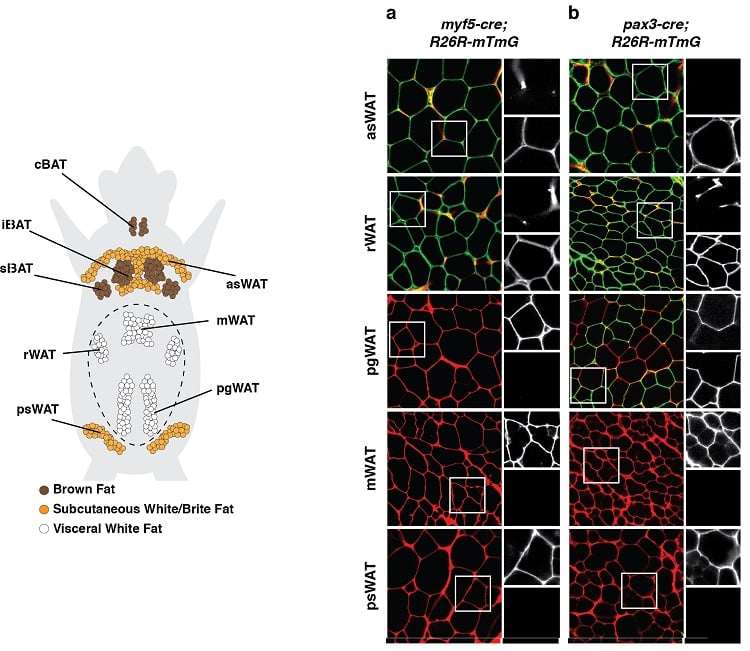
Des résultats tels que ceux-ci suggèrent que les adipocytes ont des origines développementales multiples.
(adapté de Sanchez-Gurmaches & Guertin, Nature Communications 2014 ; Sanchez-Gurmaches et al, Trends in Cell Biology 2016).
Les adipocytes bruns
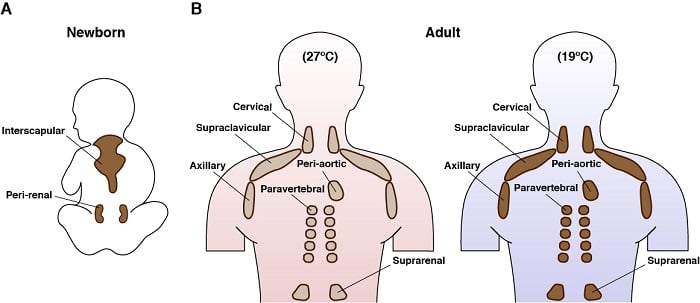
Les adipocytes bruns sont des cellules fascinantes. Ils n’existent que chez les mammifères, et leur principale fonction est de générer de la chaleur endogène dans un processus appelé thermogenèse. Cela est rendu possible par leur expression unique d’une protéine de la membrane mitochondriale appelée protéine de découplage 1 (UCP1). Les propriétés de dépense énergétique des adipocytes bruns, et le fait que l’on ait récemment constaté que les humains adultes possédaient des adipocytes bruns, en ont fait une cible pour les thérapies visant à lutter contre la suralimentation. Les adipocytes bruns actifs ont également l’un des programmes métaboliques les plus intrigants : ils absorbent et consomment simultanément de grandes quantités de divers nutriments (par exemple, glucose, lipides, acides aminés) et peuvent engager simultanément un métabolisme anabolique et catabolique. Par exemple, nous avons montré, avec d’autres, que la MTD stimulée par le froid régulait à la hausse un programme génétique qui soutient les voies de synthèse lipidique de novo en plus des voies d’oxydation des acides gras. Nous aimerions en comprendre davantage sur ce métabolisme remarquable et paradoxal.
En savoir plus sur le développement et le métabolisme du tissu adipeux brun
Localisation anatomique de la graisse brune chez l’homme
Nous utilisons également des modèles génétiques pour étudier comment les voies de signalisation contrôlent le métabolisme du BAT. Par exemple, en utilisant des souris, nous avons génétiquement supprimé Rictor – qui code pour un composant unique et essentiel de mTORC2 – uniquement dans le tissu adipeux brun. En savoir plus sur mTORC2. De façon remarquable, ces souris sont protégées contre un régime riche en graisses. Plus précisément, les souris dépourvues de BAT Rictor n’ont pas accumulé de lipides excessifs dans leur foie ou dans les dépôts de tissu adipeux viscéral lorsqu’elles ont suivi un régime riche en graisses. Il s’agit d’une découverte passionnante car le stockage excessif de lipides dans ces sites est dangereusement malsain. En utilisant une combinaison de génétique, de génomique, de métabolomique et de biochimie, nous essayons de comprendre pourquoi ces souris sont protégées du régime riche en graisses.
Adipocytes blancs
Les adipocytes blancs sont les adipocytes les plus abondants chez l’homme. Les dépôts de tissu adipeux blanc ont également une remarquable capacité d’expansion et de stockage de l’énergie, et ils envoient des signaux au cerveau et à d’autres tissus pour influencer fortement le comportement alimentaire et l’homéostasie métabolique. Cependant, bien que les adipocytes blancs soient spécifiquement adaptés pour emprisonner en toute sécurité les nutriments en excès, ils ont un point de basculement (par exemple dans l’obésité) où leurs fonctions bénéfiques échouent, ce qui favorise fortement l’apparition de maladies métaboliques et du diabète de type 2. Qu’est-ce qui définit ce point de basculement ? Comment les adipocytes blancs se signalent-ils aux autres tissus ? Quelle est l’hétérogénéité des dépôts de tissu adipeux blanc ? Pourquoi un excès de graisse viscérale est-il plus néfaste pour la santé qu’un excès de graisse sous-cutanée ? Ce sont toutes des questions en suspens qui nous intéressent.
Nous étudions également la signalisation mTOR dans les adipocytes blancs. mTOR est une cible en aval majeure de la signalisation de l’insuline, qui est la principale hormone à laquelle les adipocytes répondent. En utilisant des modèles génétiques de souris, nous avons inhibé sélectivement soit mTORC1, soit mTORC2 dans tous les adipocytes. L’inhibition de mTORC1 dans le tissu adipeux blanc provoque un syndrome de type lipodystrophie associé à une résistance à l’insuline et à une maladie du foie gras. L’inhibition de mTORC2 dans le tissu adipeux blanc provoque également une résistance à l’insuline, mais indépendamment des changements de masse du tissu adipeux. Dans ce dernier modèle, mTORC2 semble réguler un signal dérivé des adipocytes qui communique avec le foie pour contrôler la production hépatique de glucose. Comprendre la base mécanistique de ces phénotypes fournira des informations essentielles sur la façon dont les voies de transduction du signal de détection des nutriments contribuent à la pathogenèse des maladies liées au tissu adipeux.
Modèle de signalisation mTORC2 dans un adipocyte blanc
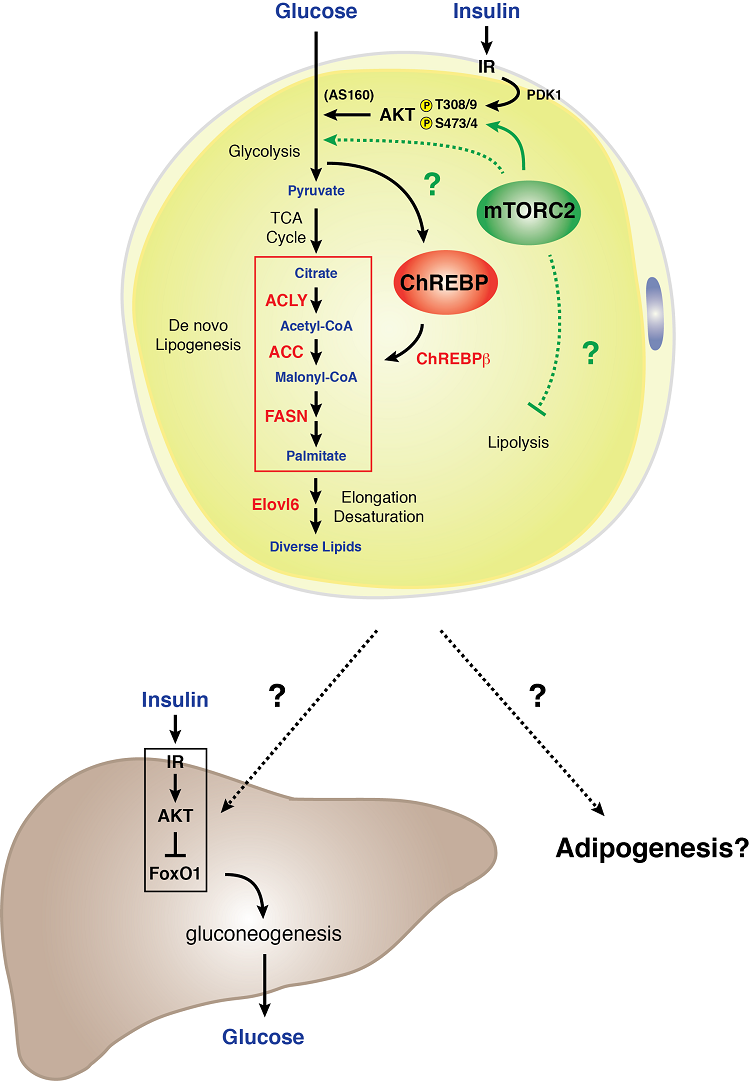 Les adipocytes blancs ont besoin de mTORC2 pour un métabolisme normal des glucides et des lipides. Nous avons découvert que la perte génétique de Rictor (mTORC2) spécifiquement dans les adipocytes blancs réduit l’absorption du glucose et atténue l’expression du facteur de transcription ChREBP-beta et de ses cibles en aval – ce qui inclut les enzymes qui fonctionnent dans la voie de la lipogenèse de novo. En outre, une déficience de mTORC2 dans les adipocytes blancs entraîne une insulinorésistance hépatique sévère. Ces données indiquent que le mTORC2 de l’adipocyte blanc est un régulateur essentiel du métabolisme des glucides et des lipides et qu’il est un élément clé d’un mécanisme de communication extra-hépatique entre les organes de détection des nutriments qui contrôle l’homéostasie systémique du glucose . La compréhension de la biologie de la signalisation de mTORC2 dans la graisse blanche peut détenir des indices importants sur la façon dont le tissu adipeux blanc fonctionne comme un organe de détection du glucose et un médiateur de la forme métabolique systémique.
Les adipocytes blancs ont besoin de mTORC2 pour un métabolisme normal des glucides et des lipides. Nous avons découvert que la perte génétique de Rictor (mTORC2) spécifiquement dans les adipocytes blancs réduit l’absorption du glucose et atténue l’expression du facteur de transcription ChREBP-beta et de ses cibles en aval – ce qui inclut les enzymes qui fonctionnent dans la voie de la lipogenèse de novo. En outre, une déficience de mTORC2 dans les adipocytes blancs entraîne une insulinorésistance hépatique sévère. Ces données indiquent que le mTORC2 de l’adipocyte blanc est un régulateur essentiel du métabolisme des glucides et des lipides et qu’il est un élément clé d’un mécanisme de communication extra-hépatique entre les organes de détection des nutriments qui contrôle l’homéostasie systémique du glucose . La compréhension de la biologie de la signalisation de mTORC2 dans la graisse blanche peut détenir des indices importants sur la façon dont le tissu adipeux blanc fonctionne comme un organe de détection du glucose et un médiateur de la forme métabolique systémique.