Chimie pour les non-majors
Objectifs d’apprentissage
- Définir le rayon atomique.
- Décrire comment l’atome change au sein d’une période.
- Décrire comment le rayon atomique change au sein d’un groupe.
Comment toutes ces personnes peuvent-elles tenir dans un si petit espace ?
 Les événements attirent un grand nombre de personnes. Même un événement en plein air peut se remplir au point qu’il n’y a plus de place pour d’autres personnes. La capacité d’accueil de la foule dépend de l’espace disponible dans le lieu de l’événement, et l’espace disponible dépend de la taille des objets qui le remplissent. Nous pouvons faire entrer plus de personnes dans un espace donné que d’éléphants, car les éléphants sont plus grands que les personnes. Pour la même raison, nous pouvons faire entrer plus d’écureuils dans ce même espace que de personnes. Connaître la taille des objets auxquels nous avons affaire peut être important pour décider de l’espace nécessaire.
Les événements attirent un grand nombre de personnes. Même un événement en plein air peut se remplir au point qu’il n’y a plus de place pour d’autres personnes. La capacité d’accueil de la foule dépend de l’espace disponible dans le lieu de l’événement, et l’espace disponible dépend de la taille des objets qui le remplissent. Nous pouvons faire entrer plus de personnes dans un espace donné que d’éléphants, car les éléphants sont plus grands que les personnes. Pour la même raison, nous pouvons faire entrer plus d’écureuils dans ce même espace que de personnes. Connaître la taille des objets auxquels nous avons affaire peut être important pour décider de l’espace nécessaire.
La taille des atomes est importante lorsqu’on essaie d’expliquer le comportement des atomes ou des composés. L’une des façons dont nous pouvons exprimer la taille des atomes est avec le rayon atomique . Cette donnée nous aide à comprendre pourquoi certaines molécules s’assemblent et pourquoi d’autres molécules ont des parties qui deviennent trop encombrées dans certaines conditions.
La taille d’un atome est définie par le bord de son orbitale. Cependant, les limites des orbitales sont floues et, en fait, variables dans différentes conditions. Afin de standardiser la mesure des rayons atomiques, on mesure la distance entre les noyaux de deux atomes identiques liés entre eux. Le rayon atomique est défini comme la moitié de la distance entre les noyaux d’atomes identiques liés entre eux.

Figure 1. Le rayon atomique (r) d’un atome peut être défini comme la moitié de la distance (d) entre deux noyaux dans une molécule diatomique.
Les rayons atomiques ont été mesurés pour les éléments. Les unités pour les rayons atomiques sont les picomètres, égales à 10-12 mètres. À titre d’exemple, on mesure que la distance internucléaire entre les deux atomes d’hydrogène d’une molécule de H2 est de 74 pm. Par conséquent, le rayon atomique d’un atome d’hydrogène est \frac{74}{2}=37\text{ pm}.
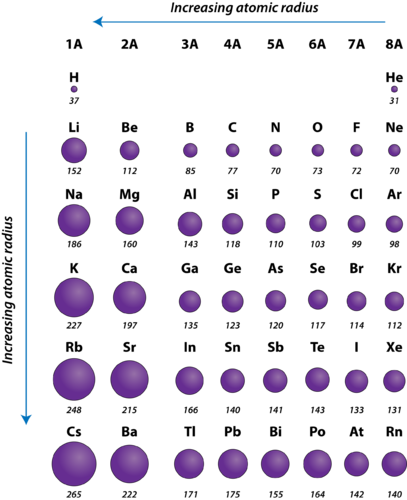
Figure 2. Rayons atomiques des éléments représentatifs mesurés en picomètres.
Tendance périodique
Le rayon atomique des atomes diminue généralement de gauche à droite à travers une période. Il y a quelques petites exceptions, comme le rayon de l’oxygène qui est légèrement supérieur à celui de l’azote. Au cours d’une période, des protons sont ajoutés au noyau alors que des électrons sont ajoutés au même niveau d’énergie principal. Ces électrons sont progressivement rapprochés du noyau en raison de sa charge positive accrue. Comme la force d’attraction entre les noyaux et les électrons augmente, la taille des atomes diminue. L’effet s’atténue au fur et à mesure que l’on se déplace vers la droite dans une période en raison des répulsions électron-électron qui, autrement, feraient augmenter la taille de l’atome.
Tendance du groupe
Le rayon atomique des atomes augmente généralement de haut en bas dans un groupe. Lorsque le numéro atomique augmente vers le bas d’un groupe, il y a à nouveau une augmentation de la charge nucléaire positive. Cependant, il y a également une augmentation du nombre de niveaux d’énergie principaux occupés. Les niveaux d’énergie principaux les plus élevés sont constitués d’orbitales dont la taille est supérieure à celle des orbitales des niveaux d’énergie inférieurs. L’effet du plus grand nombre de niveaux d’énergie principaux l’emporte sur l’augmentation de la charge nucléaire et le rayon atomique augmente donc vers le bas d’un groupe.

Figure 3. A graph of atomic radius plotted versus atomic number. Each successive period is shown in a different color. As the atomic number increases within a period, the atomic radius decreases.
Summary
- Atomic radius is determined as the distance between the nuclei of two identical atoms bonded together.
- The atomic radius of atoms generally decreases from left to right across a period.
- The atomic radius of atoms generally increases from top to bottom within a group.
Practice
Use the link below to answer the following questions:
http://chemwiki.ucdavis.edu/Inorganic_Chemistry/Descriptive_Chemistry/Periodic_Table_of_the_Elements/Atomic_Radi
- What influences the atomic size of an atom?
- What is a covalent radius?
- What is an ionic radius?
Review
- Define « atomic radius. »
- What are the units for measurement of atomic radius?
- How does the atomic radius change across a period?
- How does atomic radius change from top to bottom within a group?
- Explain why the atomic radius of hydrogen is so much smaller that the atomic radius for potassium.