Classification de la gravité de la bronchopneumopathie chronique obstructive selon les nouvelles lignes directrices 2011 de la Global Initiative for Chronic Obstructive Lung Disease : COPD Assessment Test Versus Modified Medical Research Council Scale | Archivos de Bronconeumología
Introduction
La bronchopneumopathie chronique obstructive (BPCO) touche 9,1 % de la population adulte espagnole âgée de 40 à 69 ans et est l’une des principales causes de décès par maladies non transmissibles dans le monde.1,2 Les directives de prise en charge de la BPCO précisent que le diagnostic doit inclure une spirométrie. Ce test permet de classer la gravité de la maladie en fonction du pourcentage du VEMS par rapport à la valeur prédite (VEMS%), et la stratégie de traitement est définie en conséquence.3,4 Cependant, cette procédure présente une corrélation relativement faible avec la mortalité et la symptomatologie des patients.5 Une évaluation multidimensionnelle qui intègre non seulement la fonction pulmonaire mais aussi la quantification des symptômes (par exemple, les échelles de dyspnée), l’état nutritionnel du patient et sa capacité d’exercice, comme l’indice BODE,6 a contribué à modifier la façon dont cette maladie est perçue.7
La révision de la Global Initiative for Chronic Obstructive Lung Disease (GOLD 2011) propose de stratifier les patients en fonction de la gravité de la maladie, en intégrant les symptômes déterminés à l’aide de l’échelle modifiée du Medical Research Council (mMRC) ou l’état de santé à l’aide du COPD Assessment Test (CAT), ainsi que les antécédents d’exacerbations du patient et le VEMS% post-bronchodilatateur (pb).8 Les patients sont classés en fonction du risque : risque faible (pbFEV1%≥50% ou 1
%moins de symptômes (CAT10 ou mMRC 0-1) ou plus de symptômes (CAT≥10 ou mMRC≥2). Ainsi, quatre catégories sont identifiées : A (faible risque, moins de symptômes), B (faible risque, plus de symptômes), C (risque élevé, moins de symptômes), D (risque élevé, plus de symptômes). L’approche thérapeutique proposée est différente pour chaque groupe8 (Fig. 1).
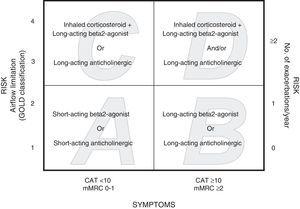
Catégories GOLD 2011 et traitement médicamenteux (première recommandation) pour chaque catégorie.
Le but de cette étude était de déterminer à partir d’une cohorte d’étude observationnelle (Centre BODE, Saragosse, Espagne) si le choix d’une échelle de symptômes (mMRC) ou d’un questionnaire mesurant la qualité de vie (CAT) est à l’origine de différences dans l’assignation aux différentes catégories de sévérité et les implications thérapeutiques correspondantes.
Patients et méthodesConception de l’étude
Le projet BODE est une étude observationnelle multicentrique visant à évaluer l’histoire naturelle de la BPCO. Les patients ont été initialement sélectionnés entre 1996 et 2000 et ont été suivis sur une base annuelle. Le protocole et les principaux résultats de santé ont été décrits précédemment.6 Le diagnostic de la BPCO a été établi selon les critères GOLD8 : pbFEV1%/FVC%20 pack-années. Entre janvier 2010 et septembre 2012, 283 nouveaux patients ont été évalués dans notre centre, et ce dernier groupe d’étude a été utilisé pour cette analyse.
Procédures
Les mesures standardisées dans la cohorte BODE comprenaient des données démographiques, des dossiers cliniques et des questionnaires sur la santé et la qualité de vie, notamment le CAT et le mMRC. Les deux évaluations ont été administrées le même jour et par le même enquêteur pour chaque patient.
Le questionnaire CAT est un outil auto-administré pour évaluer la qualité de vie du patient BPCO. Il se compose de 8 items, produisant un score de 0 à 40 ; un score plus élevé indique un état de santé moins bon.9 L’échelle de dyspnée du mMRC est un instrument qui établit la sévérité de la dyspnée par rapport à diverses tâches physiques. Elle se compose de 5 items et est notée sur une échelle de 0 (pas de dyspnée ou seulement lors d’un effort intense) à 4 (dyspnée au repos).10
La spirométrie a été réalisée avant et 20-30min après l’inhalation de 200μg de salbutamol selon une procédure standardisée.11. Tous les patients ont effectué un test de marche de 6 minutes.
L’affectation des patients aux catégories GOLD 2011 a été établie de manière indépendante, à l’aide de l’échelle mMRC (dyspnée) et de l’échelle CAT (qualité de vie). Les règles de stratification précisent que le patient doit d’abord être stratifié dans les groupes A ou C lorsque l’échelle mMRC est de 0-1 ou le score CAT est Fig. 1). Ensuite, le risque du patient doit être établi en utilisant l’une des deux procédures. Avec une procédure, les patients avec un pbFEV1%≥50% sont affectés aux catégories A ou B (faible risque) et les patients avec un pbFEV18 Une exacerbation a été définie comme sévère lorsque le patient a été vu aux urgences ou admis à l’hôpital. Les données relatives aux exacerbations précédentes ont été obtenues à partir de questionnaires administrés aux patients et des bases de données du système intranet du service de santé d’Aragon. Pour établir le risque, l’indice le plus élevé entre la limitation du débit d’air mesurée par le pbFEV1% et l’historique des exacerbations a été sélectionné.
Analyse statistique
Une analyse descriptive des caractéristiques des patients inclus dans la série a été réalisée. Les données sur les variables démographiques et cliniques, les épreuves fonctionnelles respiratoires et les épreuves d’effort ont été analysées. La cohorte de patients a été classée en quatre catégories, selon les critères GOLD 2011 (A, B, C et D), à l’aide du questionnaire CTA et, alternativement, de l’échelle mMRC. Le degré de concordance entre les résultats obtenus par l’application des deux méthodes à la même cohorte de patients a été déterminé en calculant l’indice de kappa pondéré (κ) (accord ou concordance entre des tests diagnostiques qualitatifs ordinaux). La corrélation de Spearman (estimateur non paramétrique rho ) a été calculée pour évaluer la cohérence entre les deux méthodes d’évaluation enregistrées dans l’échelle qualitative ordinale. Le test ANOVA a été utilisé pour comparer les moyennes des variables cliniques et fonctionnelles dans les quatre catégories GOLD 2011, selon que l’une ou l’autre méthode d’évaluation a été utilisée pour classer les patients. Les analyses ont été réalisées à l’aide du logiciel SPSS 19.0®.
Résultats
Sur les 283 patients inscrits à l’étude, 260 (92%) étaient des hommes et 23 (8%) des femmes. L’âge moyen était de 71±12 ans. Les principales variables démographiques, cliniques et fonctionnelles sont présentées dans le tableau 1. Le tableau 2 présente ces variables regroupées par sexe avec une évaluation des éventuelles différences significatives entre les différents paramètres analysés. Lors de cette visite, 70 (24,7%) patients étaient encore des fumeurs actifs. Le pourcentage moyen de VEMS pb était de 62,4±19,9%. La figure 2 montre la répartition des patients en fonction de leurs valeurs CAT et mMRC ; la corrélation a été calculée avec le coefficient de Spearman ρ=0,613.
Variables démographiques, cliniques et fonctionnelles (moyenne±écart-type).
| Total | 283 patients |
| Sex | 260 (92%) males; 23 (8%) females |
| Age | 71±12 years |
| BMI | 28.5±4.8 |
| Active smoker | 70 patients (24.7%) |
| PYI | 61.8±36.77 |
| Comorbidities | HT: 152 patients (53.7%); dyslipidemia: 106 (37.5%); diabetes: 53 (18.7%); cardiovascular episodes: 124 (43.8%); no comorbidity: 48 (17%) |
| pbFEV1% | 62.4%±20.3 |
| PBD(+) | 33 patients (11.6%) |
| Baseline SatO2 | 93.9%±6.3 |
| Walking test | 389.2m±96.2 |
| Spirometry results | |
| FVC | 2.8l±0.8 |
| FVC% | 76.8%±19.8 |
| FEV1 | 1.6l±0.6 |
| FEV1% | 57.5%±19.9 |
| FEV1/FVC | 0.54±0.12 |
| FEV1/FVC% | 0.74±0.17 |
| pbFVC | 3.07l±0.86 |
| pbFVC% | 82.8%±19.25 |
| pbFEV1 | 1.7l±0.7 |
| pbFEV1% | 62.4%±20.3 |
| pbFEV1/FVC | 0.55±0.13 |
| pbFEV1/FVC % | 0.75±17.8 |
FEV1%: forced expiratory volume in one second, percentage of predicted value; FVC: forced vital capacity; HT: hypertension; BMI: body mass index; PYI: pack-year index; pb: post-bronchodilator; PBD(+): positive bronchodilator test; SatO2: oxygen saturation.
Demographic, Clinical and Functional Variables by Sex (Mean±Standard Deviation).
| Males | Females | P | |
| n | 260 (92%) | 23 (8%) | |
| Age | 71.3 years±7.5 | 64.5 years±8.6 | NS (P=.3) |
| BMI | 28.6±4.7 | 27.3±7.1 | P |
| Active smoker | 60 (23.1%) | 10 (43.5%) | P |
| PYI | 62.6±33.5 | 53.3±21 | P |
| pbFEV1% | 62.9%±20.1 | 57.5%±21.8 | NS (P |
| PBD(+) | 29 (11.1%) | 4 (17.4%) | NS (P=.36) |
| Baseline SatO2 | 93.3%±6.5 | 93.4%±2.7 | NS (P |
| Walking test | 390.1m±95.1 | 380.3m±111 | NS (P |
FEV1%: forced expiratory volume in one second, percentage of predicted value; BMI: body mass index; PYI: pack-year index; NS: not significant; pb: post-bronchodilator; PBD(+): positive bronchodilator test; SatO2: oxygen saturation.
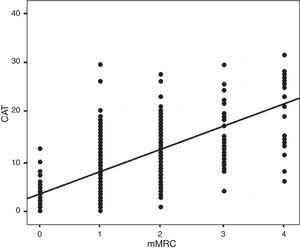
Distribution of mMRC vs CAT. Spearman correlation index: ρ=0.613; P
When the CAT questionnaire was used for classifying patients according to the GOLD 2011 criteria, the percentage distribution of patients to the groups was the following: category A, 34.3%; category B, 19.4%; category C, 19.8%, and category D, 26.5%. When the mMRC was applied, the result was: category A, 36.4%; category B, 17.3%; category C, 18.0%, and category D, 28.3% (Table 3 and Fig. 3).
Cohort GOLD 2011 Classification With CAT and mMRC (Fig. 3).
| GOLD CAT | GOLD mMRC | ||||
| A | B | C | D | Total | |
| A | 81 | 16 | 0 | 0 | 97 (35%) |
| B | 22 | 33 | 0 | 0 | 55 (19%) |
| C | 0 | 0 | 34 | 22 | 56 (20%) |
| D | 0 | 0 | 17 | 58 | 75 (26%) |
| Total | 103 (36%) | 49 (17%) | 51 (18%) | 80 (29%) | 283 (100%) |
Explanatory note: Lorsque l’échelle mMRC a été appliquée, 103 patients ont été classés en A ; parmi eux, 22 ont été classés en B lorsque le questionnaire CAT a été appliqué. De même, lorsque le CAT a été appliqué, 97 patients ont été classés A, mais 16 d’entre eux ont ensuite été classés B en utilisant le mMRC. Avec le mMRC, 49 patients ont été classés B, mais 16 d’entre eux avaient été classés A en utilisant le CAT ; avec le CAT, 55 patients ont été classés B, mais 22 d’entre eux avaient été classés A avec le mMRC. La même situation se présente pour les catégories C et D, selon que l’on applique un questionnaire ou l’autre. Il n’y a pas eu de migration entre AB et CD, car cela dépend des critères de risque (AB : risque faible ; CD : risque élevé), comme on peut le voir sur la figure 1.
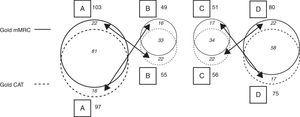
Schematic of migration between GOLD categories depending on results of the application of CAT or mMRC (see distribution of data and explanatory note in Table 3).
When the results from the application of both evaluation methods were examined, it was found that in category A, the classification of 81 patients coincided (83.5% of those classified using CAT and 78.6% of those classified with mMRC). In category B, the classification of 33 patients coincided (60% of those classified with CAT and 67.34% of those classified with mMRC). Dans la catégorie C, la classification de 34 patients a coïncidé (60,7% des patients classés CAT et 66,7% des patients classés mMRC). Dans la catégorie D, la classification de 58 patients coïncidait (77,3 % de ceux classés avec la CAT et 72,5 % de ceux classés avec la mMRC) (tableau 3 et figure 3).
Le coefficient κ pour la classification des patients à l’aide des 2 méthodes était de 0,63, indiquant un degré modéré de concordance. L’indice κ calculé était de 0,44 pour les 152 patients affectés aux catégories A et B (degré de concordance modéré-faible). L’indice pour les 131 patients classés dans les catégories C et D était de 0,38, indiquant un degré de concordance encore plus faible (faible). Cela implique que pour les catégories à faible risque (A et B), la concordance obtenue était de 75%, alors que pour les catégories à haut risque (C et D), la concordance était de 70%.
The clinical and functional characteristics of the patients in each of the GOLD 2011 categories, depending on the method applied (CAT or mMRC), are shown in Table 4. There were no differences in the categories for age and body mass index (BMI) between patients classified by mMRC or CTA. Only the pack-year index (PYI) was significantly different between category D and the other categories, regardless of whether the classification was made by mMRC or CAT (PP
PP=.003).
Main Clinical and Functional Characteristics of Patients Assigned to GOLD 2011 Categories, as Classified Using mMRC or CAT.
| mMRC | A | B | C | D | CAT | A | B | C | D |
| Age | 70.3 | 70.5 | 69.1 | 72.3 | Age | 71.3 | 68.8 | 70.1 | 71.8 |
| BMI | 28.6 | 29.1 | 28.1 | 28.2 | BMI | 28.5 | 29.3 | 28.1 | 28.2 |
| PYI | 58.4 | 62.3 | 55.7 | 69.7a | PYI | 58.35 | 61.96 | 55.40 | 70.86a |
| pb FEV1% | 75.3 | 69.1 | 56.3 | 44.5 | pb FEV1% | 73.4 | 73.1 | 54.6 | 45.2 |
| Walking test | 414 | 364b | 417 | 344c | Walking test | 400 | 396 | 400 | 354d |
Values expressed as means for each category.
P
P
P
P=.003 vs category C.
Discussion
The recent revision of the GOLD 2011 guidelines proposes that when classifying COPD patients, the medical community should take into consideration not only functional deterioration, but also symptoms and risk of exacerbations.8 Pour établir le degré de détérioration fonctionnelle, il a été proposé de conserver les mêmes grades de gravité que ceux utilisés actuellement, à savoir léger (pbFEV1%>80%), modéré (pbFEV1%≥80% et 1
%≥30% et 1% 30%). Le risque d’exacerbation est déterminé par l’historique des exacerbations dans l’année précédant l’évaluation (10 et impact élevé pour CAT≥10). Nos résultats suggèrent que l’utilisation de l’une ou l’autre méthode d’évaluation modifie l’affectation d’un nombre important de patients à l’une ou l’autre catégorie de sévérité de la BPCO selon les nouvelles recommandations GOLD. Ainsi, ces méthodes d’évaluation ne peuvent pas être considérées comme équivalentes, car différentes stratégies de traitement sont recommandées pour un patient individuel, selon l’utilisation de l’une ou l’autre méthode.
Le questionnaire CAT reflète les effets de la maladie sur la santé du patient. Il s’agit d’un questionnaire de qualité de vie spécifique à la BPCO5,9,12,13 qui évalue non seulement la dyspnée mais aussi d’autres symptômes respiratoires, comme la présence et l’intensité de la toux ou des expectorations ; il comporte également un total de 8 items, dont la capacité d’exercice, le sommeil et les activités de la vie quotidienne, produisant un score compris entre 0 et 40. Le CAT est un questionnaire simple et peut être utilisé dans la pratique clinique standard. Il s’est avéré valide pour discriminer la sévérité des patients.9,12,14,15 Cependant, il ne s’agit pas d’un outil de diagnostic ; son but est de compléter les informations obtenues par les mesures de la fonction pulmonaire et on sait très peu de choses sur son rôle pronostique potentiel.14 Ce questionnaire est particulièrement sensible à l’effet des changements de l’état de santé après les exacerbations16 et à l’effet de la réhabilitation respiratoire.17 Une revue récente a confirmé la validité du CAT (parmi d’autres questionnaires spécifiques) comme instrument de mesure de la qualité de vie dans la BPCO, lorsqu’il est comparé à d’autres outils génériques. Malheureusement, cette revue n’a pas analysé la validité du rôle du mMRC.5 Le mMRC est une échelle de dyspnée qui est plus facile à utiliser, en particulier dans les soins primaires,18 et qui peut être incorporée dans des outils multidimensionnels pour l’évaluation de la BPCO, tels que BODE6 et ADO (âge, dyspnée, obstruction).19 En outre, la dyspnée est mieux corrélée avec la qualité de vie des patients atteints de BPCO que les paramètres fonctionnels objectifs.10,15 La détermination clinique de la dyspnée révèle la capacité fonctionnelle du patient et fournit une mesure de l’efficacité du traitement,20 tout en étant en corrélation étroite avec la survie à 5 ans chez les patients atteints de BPCO.21 Elle a également montré une plus grande capacité prédictive concernant le résultat de la réhabilitation respiratoire, quel que soit le degré d’obstruction.6,18,21
Il n’y avait pas de différences significatives dans l’âge, l’IMC et le VEMS parmi les patients des groupes A et B et C et D, qu’ils aient été classés avec le mMRC ou le CAT. Cependant, la capacité d’exercice des patients des groupes B vs A et D vs C est plus faible lorsqu’ils sont classés à l’aide de la mMRC plutôt que de la CAT. Cela suggère que la dyspnée est beaucoup plus importante que la qualité de vie en tant que variable affectant la vie quotidienne des patients atteints de BPCO.
Les patients atteints de BPCO inclus dans notre cohorte ont des caractéristiques démographiques, cliniques et fonctionnelles similaires à celles d’autres études publiées dans la littérature, et la répartition des patients sur les différentes catégories est également similaire22. Dans notre série, la corrélation obtenue entre l’utilisation du CAT ou du mMRC était modérée (ρ=0.613) et similaire à celle d’une autre étude de cohorte transversale.13 Selon nos résultats, l’application du CAT ou du mMRC pour classer les patients dans les nouvelles catégories GOLD 2011 signifierait un reclassement des patients dans les catégories à faible (A et B) et à haut risque (C et D). Le calcul de l’indice de concordance selon que la CAT ou la mMRC est appliquée est modérément faible pour les catégories A-B (κ=0,44), et encore plus faible pour les catégories C-D (κ=0,38). En termes relatifs, cela se traduit par une concordance de 75% dans les catégories A et B et de 70% dans les catégories C et D. Ainsi, l’utilisation de ces deux méthodes d’évaluation n’est pas équivalente, et plus de 25% des patients sont reclassés après l’utilisation de l’une ou l’autre méthode. Ce résultat a un impact considérable sur les stratégies de traitement des patients reclassés. Les plus grandes différences de traitement se retrouvent entre les catégories A (le traitement médicamenteux de première intention recommandé est basé sur les bronchodilatateurs à courte durée d’action) et B (le traitement médicamenteux de première intention recommandé est basé sur les bronchodilatateurs à longue durée d’action et la réhabilitation pulmonaire). De petites différences ont été constatées entre les catégories C et D, n’affectant que les options de traitement médicamenteux alternatif, tandis que les recommandations de traitement non médicamenteux sont les mêmes.8
Une étude récente qui a également comparé les résultats de l’application des deux méthodes d’évaluation a conclu de manière similaire que la nouvelle classification GOLD 2011 pourrait nécessiter quelques ajustements. Ces auteurs proposent un nouveau seuil pour l’application de l’échelle mMRC (peu de symptômes=0 ; plus de symptômes≥1).23 Deux autres études, également récentes, réalisées en Corée du Sud et aux États-Unis, dans des environnements géographiques et socioculturels très différents de l’Espagne, ont obtenu des résultats identiques aux nôtres, et tiré des conclusions similaires. L’une de ces études a analysé 257 patients sud-coréens dans un seul centre, et a obtenu des résultats équivalents aux nôtres.24 L’autre étude est une étude multicentrique qui a inclus 4484 sujets nord-américains atteints de BPCO, dans le cadre de l’étude COPDGene. Ils ont analysé les résultats de l’application du mMRC ou du questionnaire SGRQ (comme substitut du CAT) et ont conclu de la même manière que le choix de l’un ou l’autre outil pour mesurer les symptômes influence l’attribution des catégories25.
Dans la dernière révision GOLD 2013, l’évaluation des patients atteints de BPCO a été augmentée avec l’inclusion du questionnaire clinique sur la BPCO (CCQ).26 Dans la section initiale de la révision, Méthodologie et résumé des nouvelles recommandations, et plus loin dans la section Évaluation des symptômes, il est précisé qu’il s’agit d’un questionnaire auto-administré spécialement conçu pour mesurer le suivi clinique des patients atteints de BPCO. La révision souligne que les données soutiennent la validité, la fiabilité et la sensibilité de ce questionnaire court et facile à administrer. Elle précise que sur la base des connaissances actuelles, le point de coupure du CCQ=0-1 peut être considéré pour classer les patients dans les groupes A et C, et un résultat de CCQ>1 peut être utilisé pour classer les patients dans les groupes B ou D. Cependant, les auteurs déclarent que d’autres études sont nécessaires pour valider la capacité discriminante et les implications pratiques du CCQ dans la détection des exacerbations dans les soins quotidiens. Et puis, par la suite, dans la section sur l’évaluation combinée de la BPCO, la même proposition d’évaluation combinée mise en avant dans les lignes directrices GOLD 2011, basée uniquement sur le CAT ou le mMRC pour l’évaluation symptomatique du degré d’atteinte de la BPCO, est maintenue, sans mention explicite du CCQ26
L’étude présentée ici présente certaines limites : la taille de l’échantillon est relativement petite, bien que la majorité des études sur les instruments de mesure de la BPCO aient un nombre similaire ou inférieur de patients5,24. En outre, comme il ne s’agit pas d’une étude transversale, la valeur pronostique des résultats n’a pas été enregistrée. Aucune corrélation avec les comorbidités n’a non plus été établie entre les différentes catégories. Les comorbidités présentées par les patients peuvent avoir un effet significatif sur le pronostic de la maladie, et devraient également être prises en compte pour l’évaluation combinée de la BPCO dans toute révision future des directives GOLD.27
Conclusions
La classification des patients BPCO en catégories selon l’évaluation combinée proposée par la révision GOLD 2011 varie selon la méthode d’évaluation utilisée lors de l’évaluation symptomatique des patients (CAT ou mMRC). Plus de 25% des patients dans les différentes catégories sont reclassés si l’une ou l’autre méthode est utilisée, ce qui implique des différences dans la stratégie de traitement recommandée. Des études longitudinales sont nécessaires pour évaluer quelle méthode d’évaluation permet de classer au mieux le patient, en prêtant attention à la capacité pronostique de ces instruments.
Conflit d’intérêts
Les auteurs déclarent n’avoir aucun conflit d’intérêts dans l’élaboration de ce manuscrit.