Comment fonctionne une batterie de voiture et comment est-elle construite ?
La fonction traditionnelle de la batterie dans le compartiment moteur est bien connue : Sans la batterie, le véhicule ne peut pas être démarré. En plus du démarreur, les bougies d’allumage, les bougies de préchauffage, les feux et les applications électroniques ont tous besoin d’énergie électrique. Mais comment est construite une batterie et comment fonctionne-t-elle ?
Les batteries plomb-acide : Composants et structure
De nombreux conducteurs prennent conscience du poids important des batteries de voiture lorsqu’ils en achètent une nouvelle. Des poids d’environ 10,5 kg, jusqu’à 30 kg sont possibles. La raison en est la présence de plaques de plomb dans les cellules de la batterie.
Composants et structure d’une cellule de batterie
Electrode positive:
- Plaque positive : Dans un accumulateur au plomb, la plaque chargée positivement (matériau actif) est constituée d’oxyde de plomb (PbO2) qui est immergé dans un électrolyte.
- Grille positive : La grille positive est constituée d’un alliage de plomb et est utilisée pour maintenir la matière active et comme collecteur de courant.
Electrode négative :
- Plaque négative : La plaque chargée négativement (matériau actif) est constituée de plomb pur (Pb), qui est également immergé dans un électrolyte.
- Plaque négative : Comme la plaque positive, elle est également constituée d’un alliage de plomb et remplit la même fonction.
Les électrodes de charges différentes sont séparées par un sac séparateur.
L’électrolyte est un mélange d’acide sulfurique (H2SO4) et d’eau distillée. Cet électrolyte peut être sous forme liquide (comme dans les batteries humides classiques ou dans la technologie EFB améliorée), sous forme de gel ou lié dans un mat de verre (comme dans la technologie AGM pour les nouvelles applications start-stop).
Plusieurs électrodes positives forment un ensemble de plaques positives et plusieurs électrodes négatives forment un ensemble de plaques négatives. Ensemble, un ensemble de plaques négatives et un ensemble de plaques positives forment un bloc de plaques. Un bloc de plaques est une cellule de batterie.
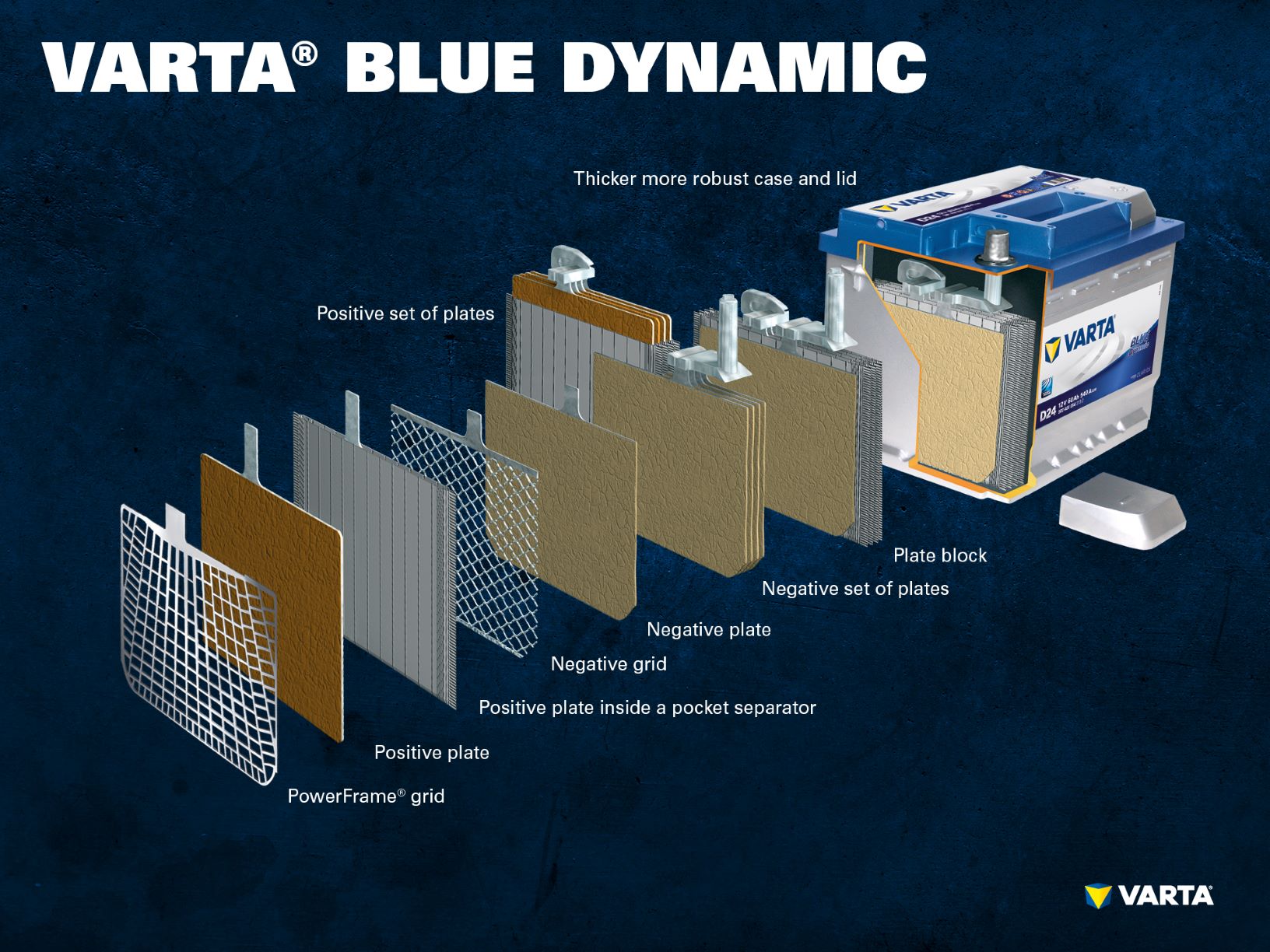
Une batterie de démarrage classique se compose de 6 cellules connectées en série, chacune ayant une tension nominale de 2 V, ce qui donne une tension d’exactement 12,72 V lorsque la batterie est complètement chargée. La capacité et l’aptitude au démarrage à froid de la batterie résultent du nombre de plaques par cellule.
Règle empirique : Plus le nombre de plaques que contient une cellule, et qui forment donc une plus grande surface, plus la puissance de démarrage à froid (CCA) que peut délivrer la batterie est importante. En revanche, si l’espace de la cellule est utilisé pour des plaques moins nombreuses, mais plus épaisses, la stabilité du cycle est accrue. Cela signifie que la batterie est conçue pour un débit de charge plus élevé (processus de charge et de décharge continu).
Les cellules sont contenues dans un boîtier qui est fabriqué en plastique résistant aux acides (polypropylène). Dans une batterie SLI classique, celui-ci est fermé par un couvercle doté d’un système de labyrinthe qui empêche le liquide de la batterie de s’échapper et sépare le liquide du gaz.
Les premières batteries étaient dotées de bouchons à vis qui permettaient de les remplir d’eau distillée. Les batteries modernes ne nécessitent aucun entretien. L’eau n’a pas besoin d’être, et ne doit pas être complétée. Bien que les batteries AGM disposent encore de « bouchons à sens unique », ceux-ci ne doivent en aucun cas être ouverts.
Fonctionnement de la batterie de voiture : L’énergie chimique devient de l’énergie électrique
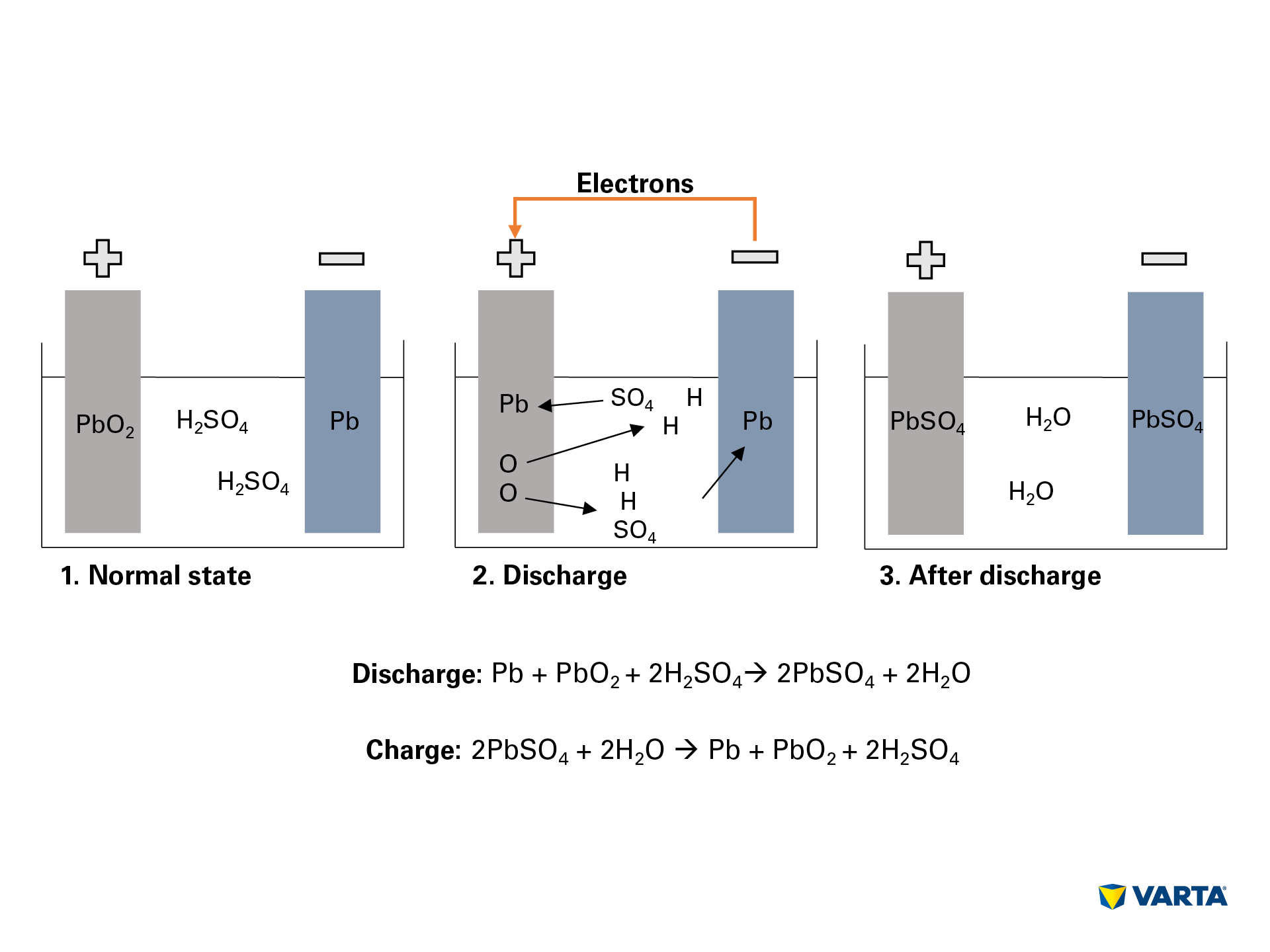
Une batterie de voiture stocke l’énergie sous forme chimique et la convertit en énergie électrique. Dans ce processus électrochimique, quatre matériaux réagissent entre eux :
- Hydrogène (H)
- Oxygène (O2)
- Plomb (Pb)
- Soufre (S)
La connexion d’un consommateur externe déclenche la réaction chimique dans la batterie :
- L’électrolyte, un mélange d’acide sulfurique (H2SO4) et d’eau distillée se décompose en ions hydrogène chargés positivement (H+) et en ions sulfate chargés négativement (SO42-).
- Au même moment, les électrons (2e-) se déplacent de l’électrode négative vers l’électrode positive via le consommateur externe.
- Pour compenser ce flux d’électrons, les ions sulfate se déplacent de l’électrolyte vers l’électrode négative, où ils réagissent avec le plomb (Pb) pour produire du sulfate de plomb (PbSO4).
- Le sulfate de plomb est également produit dans l’électrode positive : La liaison de l’oxygène (O2) dans l’oxyde de plomb (PbO2) est rompue par le transfert d’électrons et l’oxygène passe dans l’électrolyte. Le plomb (Pb) restant se lie avec le sulfate (SO4) de l’électrolyte.
- Là, l’oxygène se lie avec l’hydrogène pour former de l’eau (H2O). Au fur et à mesure que l’acide sulfurique est épuisé par la formation de sulfate de plomb, la concentration de la solution d’électrolyte diminue. Lorsque la concentration de l’acide sulfurique tombe en dessous d’un certain niveau, la batterie doit être rechargée.
- Lors de la charge, les processus chimiques se déroulent dans l’ordre inverse. A la fin, on retrouve les éléments d’origine : L’électrode positive est constituée de sulfate de plomb (PbSO4), l’électrode négative est constituée de plomb pur (Pb) et l’électrolyte est constitué d’acide sulfurique dilué (H2SO4). Comme ce processus de conversion est associé à des pertes, une batterie ne peut supporter qu’un nombre limité de cycles de charge. Sa durée de vie utile est donc limitée.
Problèmes des batteries au plomb : Sulfatation et stratification acide
Si une batterie est chargée avec une tension trop faible, ou si elle fonctionne toujours avec une tension trop faible (inférieure à 80%), il se produit une stratification acide, également appelée stratification. L’acide contenu dans l’électrolyte se stratifie en raison d’un mauvais mélange. Les différentes densités entraînent une stratification de l’acide sulfurique dans la partie inférieure et de l’eau dans la partie supérieure de la batterie. De ce fait, seule la partie centrale de l’électrolyte, c’est-à-dire seulement un tiers, peut être utilisée pour le processus de décharge et de charge.
Une cause possible de la stratification de l’acide est principalement les trajets courts avec l’utilisation simultanée d’un grand nombre de consommateurs électriques. Dans ce cas, l’alternateur n’a pas suffisamment de temps pour recharger la batterie. 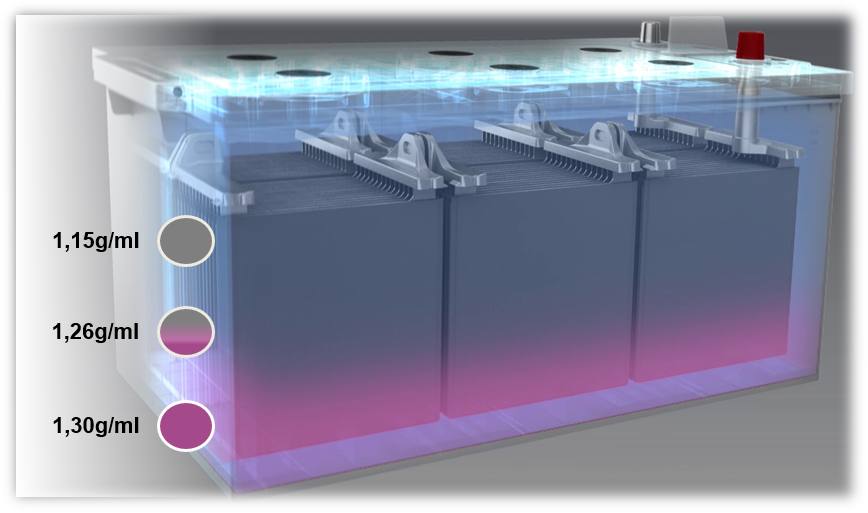
Une conséquence de la stratification de l’acide est la sulfatation. Si cela se produit dans la batterie, ou si elle n’est pas constamment chargée à un niveau adéquat, le sulfate de plomb (PbSO4) se cristallise sur les électrodes, pour former des structures cristallines plus grandes au fil du temps. Ce processus est connu sous le nom de « sulfatation ». La cristallisation empêche la reconversion du sulfate de plomb en composants d’origine, le plomb ou l’oxyde de plomb, ce qui a pour conséquence d’empêcher l’acceptation de la charge et de réduire la puissance de démarrage à froid.
Les cristaux tranchants peuvent également endommager les séparateurs ou provoquer des courts-circuits dans les cellules.
Pour contrer cet effet et prévenir une défaillance prématurée de la batterie, une batterie ne doit jamais être soumise à un faible niveau de charge sur une longue période. Pour cela, il est conseillé de tester régulièrement la batterie et de la recharger complètement si nécessaire.
Vous souhaitez en savoir plus sur ce sujet ? Comment charger correctement une batterie.
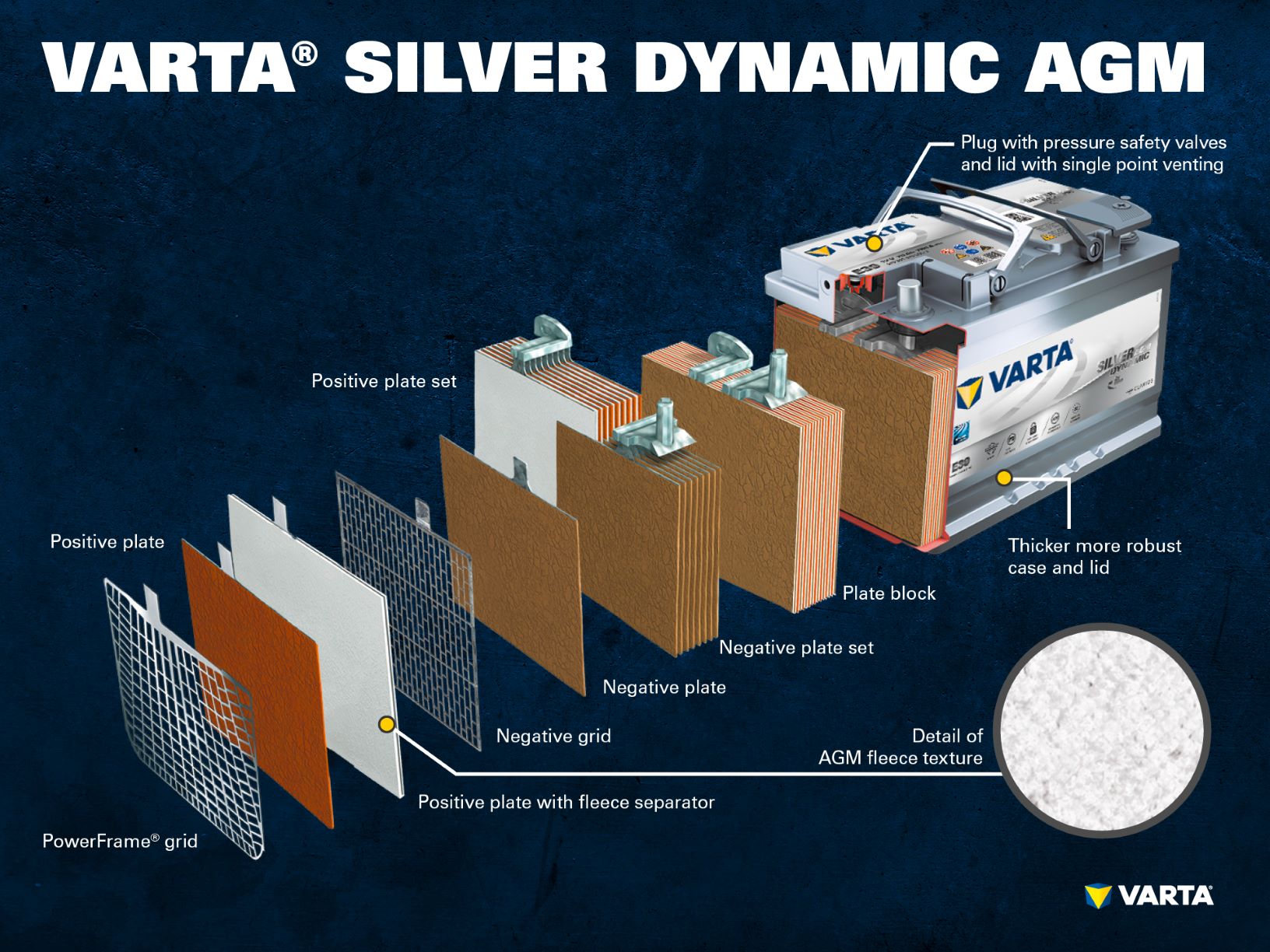
Nouvelles technologies de batterie : AGM et lithium-ion
Jusqu’à présent, les batteries conventionnelles au plomb ont eu une part élevée du marché. Cependant, le marché évolue rapidement : Les technologies de batteries innovantes pour les véhicules start-stop, telles que l’AGM, utilisent de l’acide lié dans un matelas pour offrir une plus grande stabilité de cycle et garantir des performances fiables dans les véhicules ayant des besoins énergétiques accrus. Autre avantage de l’AGM : la superposition de l’acide n’est plus possible en raison de l’acide lié.
Une nouvelle génération de batteries automobiles pour les véhicules micro-hybrides fonctionne à 48V et utilise des cellules dotées de la technologie lithium-ion.
.