Famille de l’oxygène
La famille de l’oxygène est constituée des éléments qui forment le groupe 16 du tableau périodique : l’oxygène, le soufre, le sélénium, le tellure et le polonium. Ces éléments possèdent tous six électrons dans leur niveau d’énergie le plus externe, ce qui explique certaines propriétés chimiques communes. Par ailleurs, ces éléments sont très différents les uns des autres. L’oxygène est un non-métal gazeux ; le soufre et le sélénium sont des non-métaux solides ; le tellure est un métalloïde solide ; et le polonium est un métal solide.
Mots à connaître
Acide : Substances qui, lorsqu’elles sont dissoutes dans l’eau, sont capables de réagir avec une base pour former des sels et libérer des ions hydrogène.
Allotrope : L’une des deux ou plusieurs formes d’un élément.
Combustion : Une forme d’oxydation qui se produit si rapidement que de la chaleur et de la lumière perceptibles sont produites.
Craquage : Le processus par lequel les grandes molécules d’hydrocarbures sont décomposées en composants plus petits.
Électrolyse : Le processus par lequel un courant électrique provoque un changement chimique, généralement la décomposition d’une substance quelconque.
Isotopes : Deux ou plusieurs formes d’un même élément ayant le même nombre de protons mais un nombre différent de neutrons dans le noyau atomique.
Lithosphère : La partie solide de la Terre, en particulier la région de la croûte externe.
LOX : Abréviation de l’oxygène liquide.
Métallurgie : La science et la technologie qui traitent de l’obtention des métaux à partir de leurs minerais et de leur transformation en formes ayant une valeur pratique.
Oxygène naissant : Allotrope de l’oxygène dont les molécules contiennent chacune un seul atome d’oxygène.
Ozone : Allotrope d’oxygène dont les molécules contiennent trois atomes par molécule.
Gaz de production : Un carburant synthétique qui se compose principalement de gaz de monoxyde de carbone et d’hydrogène.
Protéines : Grosses molécules essentielles à la structure et au fonctionnement de toutes les cellules vivantes.
Décroissance radioactive : La manière prévisible dont une population d’atomes d’un élément radioactif se désintègre spontanément au fil du temps.
Oxygène
L’oxygène est un gaz incolore, inodore et insipide dont le point de fusion est de -218°C (-360°F) et le point d’ébullition de -183°C (-297°F). C’est l’élément le plus abondant de la croûte terrestre. Il constitue environ un quart de l’atmosphère en poids, environ la moitié de la lithosphère (croûte terrestre) et environ 85 % de l’hydrosphère (océans, lacs et autres formes d’eau). Il est présent à la fois comme élément libre et dans une grande variété de composés. Dans l’atmosphère, il existe sous forme d’oxygène élémentaire, parfois appelé dioxygène car il est constitué de molécules diatomiques, O 2 . Dans l’eau, il existe sous forme d’oxyde d’hydrogène, H 2 O, et dans la lithosphère, il est présent dans des composés tels que les oxydes, les carbonates, les sulfates, les silicates, les phosphates et les nitrates.
L’oxygène existe également sous deux formes allotropiques (formes physiquement ou chimiquement différentes d’une même substance) : un atome par molécule (O) et trois atomes par molécule (O 3 ). Le premier allotrope est connu sous le nom d’oxygène monatomique, ou naissant, et le second sous le nom d’oxygène triatomique, ou ozone. Dans la plupart des circonstances dans la nature, la forme diatomique de l’oxygène prédomine. Toutefois, dans la partie supérieure de la stratosphère, l’énergie solaire provoque la décomposition de la forme diatomique en forme monatomique, qui peut alors se recombiner avec des molécules diatomiques pour former de l’ozone. La présence d’ozone dans l’atmosphère terrestre est essentielle à la survie de la vie sur Terre, car cet allotrope a tendance à absorber les rayonnements ultraviolets qui seraient autrement nocifs, voire mortels, pour la vie végétale et animale à la surface de la planète.
L’oxygène a été découvert indépendamment par le chimiste suédois Carl Scheele (1742-1786) et le chimiste anglais Joseph Priestley (1733-1804) entre 1773 et 1774. L’élément a été baptisé à la fin des années 1770 par le chimiste français Antoine Laurent Lavoisier (1743-1794). Son nom vient du mot français pour « formateur d’acide », reflétant la croyance incorrecte de Lavoisier que tous les acides contiennent de l’oxygène.
Production. La méthode de loin la plus courante pour produire de l’oxygène à des fins commerciales est la distillation fractionnée de l’air liquide. Un échantillon d’air est d’abord refroidi à une très basse température de l’ordre de -200°C (-330°F). À cette température, la plupart des gaz qui composent l’air deviennent liquides. On laisse ensuite l’air liquide s’évaporer. À une température d’environ -196°C (-320°F), l’azote commence à s’évaporer. Lorsque la majeure partie de l’azote a disparu, l’argon et le néon se dissolvent également, laissant derrière eux une forme impure d’oxygène. L’oxygène est impur car de petites quantités de krypton, de xénon et d’autres gaz peuvent rester sous forme liquide. Afin de purifier davantage l’oxygène, le processus de refroidissement, de liquéfaction et d’évaporation peut être répété.
L’oxygène est couramment stocké et transporté sous sa forme liquide, une forme également connue sous le nom de LOX (pour l iquid ox ygen). Les conteneurs LOX ressemblent à de très grandes bouteilles sous vide constituées d’un récipient à double paroi avec un vide entre les parois. L’élément peut également être stocké et transporté moins facilement sous forme gazeuse dans des conteneurs à parois en acier d’environ 1,2 mètre (4 pieds) de haut et 23 centimètres (9 pouces) de diamètre. Dans de nombreux cas, l’oxygène est fabriqué à l’endroit où il sera utilisé. Le procédé de distillation fractionnée décrit précédemment est suffisamment simple et peu coûteux pour que de nombreuses industries puissent fournir leurs propres installations de production d’oxygène.
Utilisations. L’oxygène a tellement d’utilisations commerciales, industrielles et autres qu’il se classe régulièrement parmi les cinq premiers produits chimiques en volume de production aux États-Unis. En 1990, par exemple, environ 18 milliards de kilogrammes (39 milliards de livres) de cet élément ont été fabriqués aux États-Unis.
Les utilisations de l’oxygène peuvent être classées en quatre grandes catégories : la métallurgie, la fusée, la synthèse chimique et la médecine. Lors du traitement du minerai de fer dans un haut fourneau, par exemple, l’oxygène est utilisé pour transformer le coke (carbone) en monoxyde de carbone. Le monoxyde de carbone, à son tour, réduit les oxydes de fer en fer métallique pur. L’oxygène est ensuite utilisé dans une deuxième étape du traitement du fer dans le convertisseur Bessemer, le foyer ouvert ou le procédé à l’oxygène de base pour convertir la « fonte brute » en acier. Dans cette étape, l’oxygène est utilisé pour réagir avec l’excès de carbone, de silicium et de métaux restant dans la fonte brute, qui doit être éliminé pour produire de l’acier.
Une autre application métallurgique de l’oxygène se trouve dans les chalumeaux utilisés pour le soudage et le découpage. Les deux chalumeaux les plus courants font appel à la réaction entre l’oxygène et l’hydrogène (le chalumeau oxyhydrogène) ou entre l’oxygène et l’acétylène (le chalumeau oxyacétylénique). Ces deux types de chalumeau produisent des températures de l’ordre de 3 000 °C (5 400 °F) ou plus et peuvent, par conséquent, être utilisés pour couper ou souder la grande majorité des matériaux métalliques.
Sous forme de LOX, l’oxygène est largement utilisé comme agent oxydant dans de nombreux types de fusées et de missiles. Par exemple, l’énorme réservoir externe de carburant nécessaire pour élever la navette spatiale dans l’espace contient 550 000 litres (145 000 gallons) d’oxygène liquide et 1 500 000 litres (390 000 gallons) d’hydrogène liquide. Lorsque ces deux éléments réagissent dans les moteurs principaux de la navette, ils fournissent une poussée maximale de 512 000 livres.
L’industrie chimique utilise chaque année de grandes quantités d’oxygène dans diverses réactions de synthèse chimique (formation). L’une des plus importantes d’entre elles est le craquage des hydrocarbures par l’oxygène. Dans la plupart des circonstances, le chauffage d’un hydrocarbure avec de l’oxygène entraîne une combustion, avec du dioxyde de carbone et de l’eau comme principaux produits. Cependant, si le taux auquel l’oxygène est introduit dans un mélange d’hydrocarbures est soigneusement contrôlé, l’hydrocarbure est « craqué », ou brisé pour produire d’autres produits, comme l’acétylène, l’éthylène et le propylène.
Divers types de carburants synthétiques peuvent également être fabriqués avec de l’oxygène comme l’un des principaux réactifs. Le gaz de production, par exemple, est fabriqué en faisant passer de l’oxygène à un débit contrôlé à travers un lit de charbon ou de coke chaud. La majeure partie du dioxyde de carbone produit dans cette réaction est réduite en monoxyde de carbone, de sorte que le produit final (le gaz producteur) se compose principalement de monoxyde de carbone et d’hydrogène.
L’application médicale la plus connue de l’oxygène est sans doute l’oxygénothérapie, qui consiste à administrer aux patients qui ont des difficultés à respirer des doses d’oxygène pur ou presque pur. L’oxygénothérapie est souvent utilisée lors d’interventions chirurgicales, pendant l’accouchement, pendant la convalescence après une crise cardiaque et pendant le traitement des maladies infectieuses. Dans chaque cas, le fait de fournir à une personne de l’oxygène pur réduit le stress subi par son cœur et ses poumons, ce qui accélère la vitesse de récupération.
L’oxygène pur ou l’air enrichi en oxygène peut également être fourni dans des environnements où la respiration peut être difficile. Les avions qui volent à haute altitude, bien sûr, sont toujours pourvus de réserves d’oxygène en cas de problème avec l’alimentation en air normale du navire. Les plongeurs en eau profonde portent également sur eux ou se font pomper des réserves d’air enrichi en oxygène.
Certaines stations de purification de l’eau et de traitement des eaux usées utilisent de l’oxygène. Le gaz est pompé dans l’eau pour augmenter la vitesse à laquelle les bactéries naturelles décomposent les déchets organiques. On a constaté qu’un processus similaire permet de réduire le taux d’eutrophisation des lacs et des étangs et, dans certains cas, d’inverser réellement ce processus. (L’eutrophisation est la dissolution des nutriments dans une masse d’eau. La croissance de la vie végétale aquatique et la diminution de l’oxygène dissous sont les deux principaux résultats de ce processus).
Enfin, l’oxygène est essentiel à toute vie animale sur Terre. Une personne peut survivre quelques jours ou semaines sans eau ni nourriture, mais pas plus de quelques minutes sans oxygène. En l’absence d’oxygène, les réactions chimiques génératrices d’énergie qui se déroulent à l’intérieur des cellules s’arrêteraient, et une personne mourrait.
Soufre
Le soufre est un élément non métallique qui peut exister sous de nombreuses formes allotropiques (formes physiquement ou chimiquement différentes d’une même substance). Les plus familières sont appelées soufre rhombique et monoclinique. Toutes deux sont des solides de couleur jaune vif dont le point de fusion est d’environ 115°C (239°F). Une troisième forme est appelée soufre plastique ou amorphe. C’est un liquide brunâtre produit lorsque le soufre rhombique ou monoclinique est fondu.
Le soufre lui-même n’a pas d’odeur du tout. Il a cependant une mauvaise réputation à cet égard, car certains de ses composés les plus courants dégagent des odeurs fortes. Le dioxyde de soufre, l’un de ces composés, a un effet vif, étouffant, suffocant sur quiconque le respire. Le « feu et le soufre » de la Bible était l’un des pires châtiments que ses auteurs pouvaient imaginer. Le soufre dans cette expression faisait référence à la combustion du soufre, ou dioxyde de soufre. Le fait que le soufre provienne des profondeurs du sol et que le dioxyde de soufre puisse être senti dans les fumées des volcans a encore alimenté l’imagination des gens sur ce que devait être l’enfer.
Un deuxième composé du soufre dégageant une mauvaise odeur est le sulfure d’hydrogène. La forte odeur des œufs pourris est due à la présence de ce composé.
Organisation et préparation. Le soufre est le seizième élément le plus abondant dans la croûte terrestre. Il est présent à la fois en tant qu’élément et dans une variété de composés. En tant qu’élément, on peut le trouver dans de très grandes mines souterraines, le plus souvent le long de la côte du Golfe des États-Unis et en Pologne et en Sicile. Le soufre est extrait de ces mines au moyen du procédé Frasch. Dans ce procédé, de la vapeur surchauffée est pompée dans la partie la plus extérieure d’un ensemble de trois tuyaux. De l’air comprimé est envoyé dans le tuyau le plus à l’intérieur. La vapeur surchauffée fait fondre le soufre souterrain, et l’air comprimé le pousse vers le haut, par le milieu des trois tuyaux, jusqu’à la surface de la Terre.
Le soufre est également largement répandu sous forme de minéraux et de minerais. Beaucoup d’entre eux se présentent sous forme de sulfates, notamment le gypse (sulfate de calcium, CaSO 4 ), la barytine (sulfate de baryum, BaSO 4 ) et les sels d’Epsom (sulfate de magnésium, MgSO 4 ). D’autres sont des sulfures métalliques, notamment la pyrite de fer (sulfure de fer, FeS 2 ), la galène (sulfure de plomb, PbS), le cinabre (sulfure mercurique, HgS), la stibnite (sulfure d’antimoine, Sb 2 S 3 ) et la blende de zinc (sulfure de zinc, ZnS). Le soufre est récupéré de ces minerais métalliques en les chauffant fortement à l’air, ce qui transforme le soufre en dioxyde de soufre et libère le métal pur. Le dioxyde de soufre peut ensuite entrer directement dans la fabrication d’acide sulfurique, où aboutissent plus de 90 % du soufre extrait dans le monde.
Utilisations du soufre et de ses composés. Une partie du soufre est utilisée directement comme fongicide et insecticide, dans les allumettes, les feux d’artifice et la poudre à canon, et dans la vulcanisation du caoutchouc naturel (un traitement qui confère au caoutchouc élasticité et résistance). La plupart, cependant, est transformée en une multitude de composés utiles.
L’acide sulfurique est de loin le plus important de tous les composés du soufre. Près de 90 % de tout le soufre produit est d’abord transformé en dioxyde de soufre, puis en acide sulfurique. Cet acide se classe systématiquement au premier rang des produits chimiques fabriqués aux États-Unis. En 1990, plus de 40 milliards de kilogrammes (89 milliards de livres) d’acide sulfurique ont été fabriqués, soit plus de 50 % de plus que le deuxième produit chimique le plus populaire (l’azote gazeux). L’acide sulfurique est utilisé dans la production d’engrais, de batteries automobiles, de produits pétroliers, de pigments, de fer et d’acier, et de nombreux autres produits.
Le cycle du soufre. Comme l’azote, le carbone et le phosphore, le soufre passe par les parties gazeuses, liquides et solides de notre planète dans une série de réactions continues connue sous le nom de cycle du soufre. Les principales étapes du cycle du soufre sont illustrées dans la figure ci-jointe.
Le soufre est produit naturellement à la suite d’éruptions volcaniques et par les émissions des sources chaudes. Il pénètre dans l’atmosphère principalement sous forme de dioxyde de soufre, puis y reste sous cette forme ou, après avoir réagi avec l’eau, sous forme d’acide sulfurique. Le soufre est ramené à la surface de la Terre sous forme de dépôts acides lorsqu’il pleut ou qu’il neige.
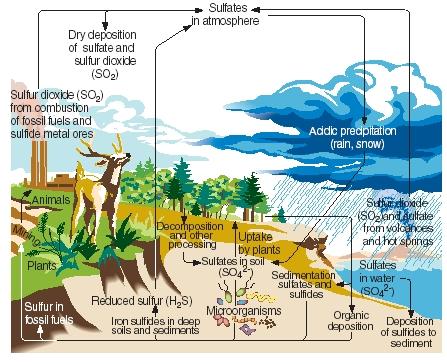
.)
À la surface de la Terre, le dioxyde de soufre et l’acide sulfurique réagissent avec les métaux pour former des sulfates et des sulfures. L’élément est également incorporé par les plantes sous une forme appelée soufre organique. Certains acides aminés, les composés à partir desquels les protéines sont fabriquées, contiennent du soufre. Le soufre organique des plantes est finalement transmis aux animaux qui mangent ces plantes. Il est, à son tour, transformé des protéines végétales en protéines animales.
Lorsque les plantes et les animaux meurent, le soufre retourne dans le sol où il est transformé par des micro-organismes en sulfure d’hydrogène. Le sulfure d’hydrogène gazeux est ensuite renvoyé dans l’atmosphère, où il est oxydé en acide sulfurique.
Les activités humaines influencent le cycle du soufre de plusieurs manières. Par exemple, lors de l’extraction du charbon et des minerais métalliques, du soufre et des sulfures peuvent être libérés et renvoyés dans le sol. De même, la combustion du charbon, du pétrole et du gaz naturel libère souvent du dioxyde de soufre dans l’atmosphère. Ce dioxyde de soufre s’ajoute à la quantité déjà présente de sources naturelles, ce qui augmente considérablement la quantité de précipitations acides qui tombent à la surface de la Terre. Certaines personnes pensent que les précipitations acides (ou pluies acides) sont responsables de la mort d’arbres et d’autres plantes, de l’acidification des lacs qui a nui aux animaux marins, des dommages causés aux structures en métal et en pierre, et d’autres dommages environnementaux.
Sélénium, tellure et polonium
Le sélénium et le tellure sont deux éléments relativement rares. Ils se classent dans les dix derniers pour cent de tous les éléments en termes d’abondance. Ils ont tendance à se trouver dans la croûte terrestre en association avec des minerais de cuivre et d’autres métaux. Ils sont tous deux obtenus comme sous-produit du raffinage électrolytique du cuivre. Au cours de ce processus, ils coulent au fond de la cuve d’électrolyse, où ils peuvent être retirés de la boue qui se développe.
Le sélénium se présente sous diverses formes allotropiques (formes physiquement ou chimiquement différentes d’une même substance), dont la plus courante est une poudre rouge qui devient noire lorsqu’elle est exposée à l’air. Le point de fusion de l’élément est de 217°C (423°F), et son point d’ébullition est de 685°C (1 265°F). Le tellure est un solide blanc argenté qui ressemble à un métal (bien qu’il s’agisse en fait d’un métalloïde). Son point de fusion est de 450°C (842°F), et son point d’ébullition est de 990°C (1 814°F).
Le sélénium a un rôle intéressant dans les organismes vivants. Il est indispensable à très faible concentration pour maintenir la santé de la plupart des animaux. Il est d’ailleurs souvent ajouté aux aliments pour animaux. En revanche, à des concentrations plus élevées, on a constaté que l’élément avait des effets néfastes sur les animaux, provoquant des jeunes déformés et des adultes malades.
Les principales utilisations du sélénium sont dans l’électronique et dans la fabrication de verre coloré. Les photocopieuses, les cellules solaires, les cellules photoélectriques, les tubes cathodiques des téléviseurs, les redresseurs et les relais électroniques (utilisés pour contrôler le flux du courant électrique) utilisent tous du sélénium. Certains des plus beaux verres colorés, allant du rose pâle au rouge brillant, sont fabriqués avec des composés de sélénium.
De petites quantités de tellurium sont également utilisées dans la production de verre coloré. Plus de 90 % de l’élément, cependant, sert à la production d’alliages de fer et d’autres métaux.
Le polonium possède 27 isotopes, qui sont tous radioactifs. Il est présent à l’état naturel dans les minerais d’uranium, où il est le produit final de la longue série de réactions par lesquelles l’uranium subit une désintégration radioactive. Il s’agit de l’un des éléments les plus rares sur Terre, dont l’abondance ne dépasse pas environ 3 × 10 -10 parties par million. La découverte du polonium en 1898 par la chimiste franco-polonaise Marie Curie (1867-1934) est l’une des histoires les plus dramatiques de l’histoire des sciences. Elle a traité des tonnes de minerai d’uranium afin d’obtenir quelques milligrammes de ce nouvel élément, qu’elle a ensuite baptisé du nom de sa patrie, la Pologne. Le polonium trouve un usage limité dans les dispositifs de production d’énergie hautement spécialisés, tels que ceux utilisés pour les satellites et les sondes spatiales.