Frontières en Neurologie
Introduction
La paralysie horizontale bilatérale du regard est une présentation rare causée par une interruption bilatérale du faisceau longitudinal médian, du noyau abducens ou de la formation réticulaire pontine paramédiane (FRPP) (1, 2). Les types de mouvements oculaires qui peuvent être affectés par des lésions du tronc cérébral comprennent les mouvements oculaires lents horizontaux et verticaux, les mouvements de poursuite, les réponses vestibulaires et optocinétiques, et les mouvements oculaires rapides, y compris les saccades volontaires ou évoquées et les phases rapides des stimuli vestibulaires et optocinétiques. Le contrôle de la vergence peut être affecté par des lésions du mésencéphale.
La paralysie du regard horizontal a été décrite comme une conséquence d’un infarctus (3), d’une inflammation/démyélinisation dans le cadre de la sclérose en plaques (SEP) ou des troubles du spectre de la neuromyélite optique (NMOSD) (2, 4, 5), d’une hémorragie (6) et de métastases (7). Parmi les cas non vasculaires/tumoraux précédemment rapportés, cinq sur six présentaient des paralysies horizontales bilatérales du regard et trois présentaient des lésions solitaires à l’imagerie par résonance magnétique (IRM), localisées dans le tegmentum pontin. Milea et al. (1) ont rapporté deux cas d’ophtalmoplégie internucléaire (INO) bilatérale se transformant en paralysie horizontale bilatérale du regard avec des lésions uniques rehaussées en T2 au même endroit et présentant la même morphologie que notre série de cas. Ils ont suggéré la SEP comme diagnostic probable.
Henderson a décrit un patient présentant une diplopie horizontale au regard latéral gauche et une faiblesse de l’adduction (8). L’IRM cérébrale a démontré une lésion solitaire T2 hyperintense du tronc cérébral adjacente au quatrième ventricule, et un diagnostic de SEP a été posé. En l’absence d’informations cliniques supplémentaires, il est difficile de discerner comment ce diagnostic a été posé. Matsui et al. ont rapporté un patient se plaignant d’une diplopie horizontale avec parésie bilatérale du regard horizontal (9). Un diagnostic d’encéphalite du tronc cérébral de Bickerstaff (BBE) a été posé bien que les caractéristiques cliniques ne correspondent pas aux critères diagnostiques (10).
Nous décrivons ici trois patients présentant une parésie bilatérale du regard horizontal, causée dans chaque cas par une lésion inflammatoire solitaire affectant le tegmentum dorsal du pons s’étendant vers l’avant jusqu’à la région du faisceau longitudinal médian (FML). Nous pensons que ces trois cas mettent en lumière des questions concernant la pathogenèse de tels syndromes et la relation entre la projection liée au regard horizontal et vertical dans le FML en particulier.
Conformément aux exigences éthiques de notre institution, l’hôpital Royal Melbourne, un consentement éclairé et écrit pour l’utilisation de données anonymes a été obtenu de tous les patients.
Patient 1
Un homme de 38 ans d’origine turque a présenté une diplopie intermittente aiguë, des vertiges et des vomissements ; il a été diagnostiqué avec un vertige périphérique et est sorti de l’hôpital. Une semaine plus tard, il s’est présenté à nouveau avec un engourdissement facial du côté gauche. Ses antécédents médicaux personnels, son examen des systèmes et ses antécédents familiaux étaient sans particularité.
L’acuité visuelle était de 0,63 OU, mesurée sur l’échelle décimale. Le diamètre de la pupille était de 5 mm bilatéralement et non réactif. L’examen de la motilité oculaire (tableau 1) a révélé une défaillance complète de tous les mouvements oculaires horizontaux, des saccades volontaires, de la poursuite lisse, des mouvements vestibulaires et optocinétiques. Les saccades verticales, la poursuite lisse et les mouvements vestibulaires étaient intacts à l’examen clinique, mais cela n’exclut pas la possibilité d’un ralentissement mineur qui aurait nécessité une oculographie pour être identifié. L’examen neurologique était par ailleurs normal.
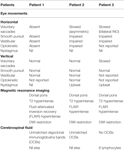
Tableau 1. Résumé des résultats cliniques oculomoteurs, des résultats d’imagerie IRM et des résultats du LCR.
L’IRM cérébrale a montré une lésion triangulaire hyperintense T2 et FLAIR (fluid-attenuated inversion recovery) au sein du pons dorsal dans le plancher du quatrième ventricule (figure 1A). La lésion présentait une diffusion légèrement restreinte selon la cartographie du coefficient de diffusion apparent, ce qui correspond aux rapports de la littérature sur les lésions inflammatoires/démyélinisantes (11, 12), et ne présentait pas de rehaussement de contraste. L’IRM du cerveau et de la colonne vertébrale était par ailleurs sans particularité. La lésion du tronc cérébral a été considérée comme présentant des caractéristiques compatibles avec une démyélinisation, bien qu’aucune autre lésion n’ait été observée. La maladie de Behçet, une vasculite ou une lésion mitotique ont été considérées comme des diagnostics différentiels.
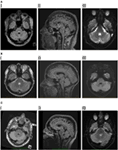
Figure 1. (A) I. Patient 1, récupération axiale par inversion atténuée par le fluide (FLAIR) montrant une lésion hyperintense dans le tegmentum pontin postérieur. II. FLAIR sagittale montrant l’étendue verticale de la lésion. III. Imagerie pondérée par diffusion montrant une légère restriction de diffusion. (B) I. Patient 2, dual axial montrant une lésion hyperintense dans le tegmentum pontin postérieur. II. FLAIR sagittal montrant l’extension verticale de la lésion. III. Imagerie pondérée par diffusion montrant une légère restriction de diffusion. (C) I. Patient 3, flair axial montrant une lésion hyperintense dans le tegmentum pontin postérieur, légèrement plus importante du côté droit. II. FLAIR sagittal montrant l’étendue verticale de la lésion, légèrement plus importante que chez les deux patients précédents, ce qui correspond à un certain ralentissement des saccades verticales. III. Imagerie pondérée par diffusion montrant une légère restriction de diffusion.
L’analyse du liquide céphalorachidien (LCR) a révélé trois lymphocytes, aucun polymorphe et aucun globule rouge, des bandes d’immunoglobulines oligoclonales (BOC) ont été vues dans le LCR et n’étaient pas appariées dans le sérum. Il y avait une élévation minimale des protéines (0,46 g/l), mais les tests étaient négatifs pour l’anti-aquaporine 4 (Aq4). L’Aq4 sérique était également négatif. La recherche d’anticorps anti-gangliosides n’a pas été effectuée et les anticorps anti-glycoprotéine oligodendrocytaire de la myéline (MOG) n’étaient pas disponibles au moment de la maladie aiguë mais étaient négatifs lorsqu’ils ont été disponibles 2 ans plus tard.
Le patient a été traité pour une démyélinisation présumée et s’est amélioré après 3 jours de méthylprednisolone par voie intraveineuse (IV) de 1 g. Son examen neurologique était revenu à la normale lors de l’examen 3 semaines après sa sortie. Les IRM cérébrales sérielles ont démontré une résolution complète de la lésion pontine, sans nouvelles lésions observées, et aucun autre épisode clinique sur 2 ans depuis la présentation initiale.
Patient 2
Une femme de 46 ans présentant des céphalées frontales a été traitée pour une migraine et a initialement répondu au naproxène et à l’amitriptyline. Six jours plus tard, elle s’est présentée à nouveau avec une aggravation des céphalées, une photophobie, une vision floue, une diplopie horizontale intermittente et un engourdissement facial fluctuant.
Ses antécédents médicaux et familiaux étaient sans particularité. L’examen neuro-ophtalmique a révélé une acuité visuelle de 0,32 OU. Les réponses pupillaires ont été signalées comme légèrement lentes mais réactives bilatéralement. L’examen oculomoteur est résumé dans le tableau 1. Il y avait une parésie bilatérale asymétrique du regard horizontal, la droite étant pire que la gauche. Les saccades vers la droite étaient limitées en amplitude et lentes. Les réponses vestibulaires étaient asymétriques, les mouvements oculaires provoqués par la manœuvre de la tête de poupée étant normaux dans l’œil gauche mais limités dans l’œil droit. Les réponses plus actives à la poussée de la tête étaient hypoactives dans les deux sens. Le nystagmus de haut en bas était le plus évident lors du regard vers le haut, mais avec l’ophtalmoscopie, il a également été noté en position primaire. Les saccades verticales, vers le haut et vers le bas, étaient normales. La poursuite verticale lisse semblait intacte. Les poussées verticales de la tête et les réponses optocinétiques étaient cliniquement normales. L’oculographie vidéo n’était pas disponible et, dans l’ensemble, ces résultats ont été interprétés comme étant compatibles avec une légère déficience du regard vertical. Le nystagmus vertical s’est résolu en deux jours. Elle présentait également une légère faiblesse faciale bilatérale, une absence de réflexes tendineux dans les membres supérieurs et une légère ataxie de la marche. L’impression clinique était que sa constellation de symptômes correspondait au syndrome de Miller Fisher, à l’EBS ou à une démyélinisation centrale, mais sans preuve pour confirmer le diagnostic de ces entités lors des tests.
L’imagerie par résonance magnétique cérébrale a révélé un foyer paramédian solitaire et bien défini d’hyperintensité T2 dans le pons dorsal qui présentait une diffusion légèrement restreinte mais aucun rehaussement de contraste (figure 1B). L’IRM du rachis était normale.
Les études de conduction nerveuse ont révélé une neuropathie axonale motrice faciale bilatérale. L’analyse du LCR a mis en évidence des OCB (non appariés) et une albuminémie élevée (298 mg/l). L’anticorps Aq4 sérique était négatif. Les résultats de routine du LCR étaient normaux, y compris les protéines 0,4 g/l, le nombre de globules blancs (WCC) et le nombre de globules rouges (RCC) < 1. Le LCR était négatif pour les anticorps anti-AQP4, anti-GM1, anti-GQ1B et anti-protéine myéline-oligodendrocyte.
Le diagnostic était celui d’une encéphalite localisée limitée au pons et touchant principalement le tegmentum dorsal. Le patient a été traité par une cure de 5 jours d’immunoglobuline IV de 2 g/kg. Au cours de la semaine suivante, l’ophtalmoplégie s’est nettement améliorée, les réflexes des membres supérieurs se sont améliorés et l’ataxie a disparu. Aucun nouveau symptôme ni aucune nouvelle lésion n’ont été identifiés au cours des 12 mois de suivi. L’examen à 18 mois a confirmé une récupération clinique complète.
Patient 3
Cet homme de 29 ans s’est réveillé avec des sueurs et des frissons, suivis de céphalées bifrontales, de vertiges posturaux, de nausées et de vomissements. Lors de la présentation 12 heures plus tard, il présentait une diplopie horizontale et un engourdissement du côté droit. Il a révélé un historique de 5 jours de symptômes des voies respiratoires supérieures, de sinus bloqués, et un rappel de vaccination contre la coqueluche 1 mois avant l’apparition des symptômes. Ses antécédents comprenaient une hypertension, une hypothyroïdie, une anxiété, un syndrome du côlon irritable, une obésité et une stéatohépatite non alcoolique.
L’imagerie par résonance magnétique cérébrale a révélé une lésion dorsale pontine T2 hyperintense non rehaussée du côté gauche, qui présentait une diffusion restreinte (figure 1C). Le LCR était remarquable pour un CCM élevé de 8 × 106/l (7 lymphocytes, 1 neutrophile), le CCR était de 4 × 106/l et les protéines du LCR étaient de 0,35 g/l. Le diagnostic initial était celui d’un accident vasculaire cérébral ischémique, dans un autre établissement, et un traitement médical de prévention secondaire a été instauré. Aucune anomalie n’a été trouvée à l’angiographie par résonance magnétique, au monitorage cardiaque, à l’échocardiogramme transœsophagien, aux dépistages de la vascularite et de la thrombophilie.
Deux semaines après le début, il a développé une altération du goût du côté gauche, un engourdissement de la langue gauche, de l’intérieur de la bouche et du visage. Son acuité visuelle monoculaire était de 1,0 OU, mais son acuité visuelle dynamique était de 0,4 OU. Les réponses des pupilles étaient normales. Il présentait une parésie bilatérale du regard et une INO (tableau 1). Les réponses à la poussée de la tête étaient bilatéralement hypoactives avec des saccades vers le haut légèrement ralenties et un nystagmus à la hausse lors du regard vers le haut. Le reste de l’examen neurologique n’a révélé qu’une légère dysmétrie gauche.
L’analyse répétée du LCR a révélé 3 leucocytes (indifférenciés), 27 globules rouges, et négatif pour les OCB. L’IRM cérébrale sans contraste a révélé un élargissement de la lésion avec une diffusion restreinte persistante. Les apparences étaient compatibles avec une démyélinisation. Les anticorps anti-ganglioside sériques, l’anticorps anti-aquaporine-4 (AQP4) et les anticorps anti-MOG étaient négatifs.
Il a été traité par un traitement de 3 jours de 1 g quotidien de méthylprednisolone IV suivi de 60 mg de prednisolone orale par jour, sevré lentement après 1 mois. Un examen de suivi 8 semaines après la première présentation a montré une INO gauche résiduelle et des symptômes sensoriels à droite seulement, qui ont disparu au cours des mois suivants. La lésion a complètement disparu lors de l’imagerie de suivi 3 mois plus tard.
Discussion
Nous décrivons trois cas de parésie bilatérale du regard horizontal, coïncidant avec le développement aigu d’une petite lésion bien circonscrite du tegmentum pontin à l’IRM. Par définition, ces cas représentent des syndromes cliniquement isolés mais en l’absence de lésions récurrentes dans les 12-36 mois de suivi. Ce phénotype est décrit dans la SEP, les NMOSD, les accidents vasculaires cérébraux et les tumeurs (1, 4, 5, 8, 9, 13, 14). Cependant, les patients présentant ces diagnostics ont tendance à développer des rechutes et des modifications IRM caractéristiques (4, 15). Dans nos cas, il n’y a pas de preuve suffisante pour l’un de ces diagnostics à la présentation ou lors du suivi. Nous nous concentrons ici sur les nouveautés cliniques et anatomiques proposées qu’ils démontrent.
Les troubles du spectre anti-GQ1b peuvent affecter les mouvements oculaires et pourraient potentiellement présenter les caractéristiques cliniques que nous avons décrites. Le syndrome de chevauchement Miller-Fisher/BBE a été envisagé dans le deuxième cas, mais ces patients ont tendance à présenter des anticorps anti-GQ1B positifs et un cerveau normal à l’IRM (13). En conséquence, nous pensons qu’un autre diagnostic est plus probable. Bien que la NMOSD puisse présenter des lésions inflammatoires près du tegmentum pontin, elles sont typiquement légèrement plus basses au niveau du plancher du quatrième ventricule. Les cas rapportés ici ne remplissent pas les critères récemment mis à jour pour la NMOSD (16).
De même, le syndrome de CLIPPERS est un trouble inflammatoire du tronc cérébral, mais il est cliniquement et radiologiquement plus diffus et peu susceptible d’être une explication chez nos patients (17).
Le contrôle du regard vertical est généralement attribué au mésencéphale rostral, au noyau interstitiel rostral du MLF (riMLF) contenant les cellules de burst, et au noyau interstitiel de Cajal formant l’intégrateur neuronal pour le maintien de la position dans l’orbite. Ces régions se projettent bilatéralement, en partie via la commissure postérieure. Les entrées dans ces zones proviennent d’un certain nombre de sources, dépendant en partie du type d’entrée.
Les entrées vestibulaires proviennent des noyaux vestibulaires supérieurs de manière bilatérale, tandis que les signaux de poursuite lisse se projettent du groupe de cellules Y vers le FMLR. Les voies d’accès comprennent le FML, le tractus tegmental ventral et les voies cérébelleuses. Les saccades verticales volontaires et réflexes, déterminées par des réseaux supratentoriels, semblent dépendre des projections de la région PPRF de manière bilatérale, et sont abolies par des lésions localisées du PPRF caudal de manière bilatérale uniquement (18). Une forte projection de neurones omnipuissants a été démontrée à partir du PPRF, bilatéralement, vers le riMLF (19, 20). Ceux-ci doivent être inhibés pour que des saccades volontaires et réflexes, et non des phases rapides, soient générées (21).
Le regard vertical peut être épargné en présence d’une ophtalmoplégie horizontale avec une lésion tegmentale du pont postérieur avec ou sans pathologie plus étendue (1, 13). Bien que les lésions abducens pures puissent produire une paralysie du regard horizontal, les cas rapportés par Milea et al. se sont présentés précocement avec une INO bilatérale, ce qui suggère une atteinte soit de la FML, soit des projections bilatérales dans la FML.
La lésion unificatrice, chez nos patients et ceux référencés ici, est la lésion tegmentale postérieure. Cette lésion est à proximité immédiate des noyaux abducens et du PPRF contenant les cellules excitatrices de burst pour le regard horizontal. Une atteinte bilatérale des projections du FPRP ou des noyaux abducens expliquerait la paralysie du regard horizontal. La relative épargne des mouvements oculaires verticaux implique que les signaux verticaux bilatéraux se projetant vers le centre du regard vertical de la formation réticulaire mésencéphalique via la FML (22), empruntent une voie distincte dans le pons, par rapport aux entrées du regard latéral. Ceci est cohérent avec les preuves de Pierrot-Deseilligny et al. (7), sur la paralysie bilatérale dissociée du regard horizontal, mais en désaccord avec la perception clinique conventionnelle actuelle de l’anatomie dans cette région.
S’il y a des lésions bilatérales des centres du regard latéral dans le PPRF, étroitement associé et presque indiscernable du noyau abducens, la sagesse conventionnelle indiquerait qu’il devrait y avoir des paralysies du regard vertical également, car ces voies sont censées courir ensemble. Il est certain que les lésions de la ligne médiane affectant les deux fascicules longitudinaux médians (FML) produisent une INO bilatérale qui est associée de manière caractéristique à une parésie du regard vertical, caractérisée par une altération de la poursuite lisse verticale et une annulation du réflexe vestibulo-oculaire (23). Des lésions plus rostrales peuvent affecter les structures du mésencéphale (riMLF et INC) impliquées dans les saccades verticales (24). Aucune altération du regard vertical de ce type n’est observée chez nos patients.
Nous suggérons que les voies du regard vertical et du regard horizontal parcourent séparément leur parcours inférieur et fusionnent dans leur parcours rostral, les entrées du regard vertical étant antérolatérales aux entrées du regard horizontal. Elles peuvent se croiser dans leur trajet ascendant, probablement de manière substantielle, de sorte que des lésions bilatérales sont nécessaires pour produire une paralysie du regard vertical. Cela expliquerait l’épargne de la voie directe du regard vertical à partir du PPRF latéral en présence d’une lésion unilatérale, l’abolition des mouvements oculaires verticaux avec des lésions localisées bilatérales, et la nécessité d’une stimulation bilatérale pour provoquer des mouvements oculaires verticaux (18, 22).
Nous proposons un arrangement anatomique légèrement modifié pour représenter cela (figure 2). Les voies du regard horizontal se projettent vers le noyau abducens ipsilatéral, puis remontent dans la FML jusqu’au sous-noyau droit médial controlatéral du troisième noyau nerveux. Nous proposons que le signal du regard vertical se projette plus antérieurement dans la FML et, au moins sur une courte distance, soit séparable des voies des fibres du regard horizontal.
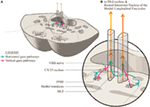
Figure 2. (A) Une section à travers le milieu du plexus montrant la relation de la formation réticulaire pontine paramédiane avec le fascicule longitudinal médian (FML) et le septième nerf crânien adjacent, alors qu’elle balaie le noyau abducens. (B) Agrandissement montrant la conformation proposée des trajectoires distinctes du regard, horizontale et verticale, lorsqu’elles se projettent dans le FML. Le signal horizontal se décussera au niveau du pons et remontera dans la FML controlatérale tandis qu’il n’est pas certain que le signal de regard vertical se décussera tout court ou sera une projection directe.
Les similitudes dans le phénotype et la morphologie des lésions causales dans ces cas suggèrent que cette région du tegmentum pontin pourrait avoir des caractéristiques particulières la rendant sensible à une attaque immunologique. Aucun de ces cas ne remplit les critères d’autres maladies, inflammatoires ou autres, associées à l’atteinte de la FML.
Si effectivement ces cas représentent un phénotype nouveau, il est alors nécessaire de discerner le déroulement optimal de la prise en charge, à la fois pendant la phase aiguë et à plus long terme. Un diagnostic erroné, par exemple avec une SEP ou un accident vasculaire cérébral, risque d’exposer le patient à un traitement antiplaquettaire ou immunomodulateur à long terme inutile et à l’anxiété autour du diagnostic d’une affection à long terme importante, potentiellement récurrente, avec un impact négatif associé sur ses choix de vie et ses options.
L’identification d’autres cas de ce phénotype serait utile pour faciliter la recherche de nouveaux anticorps spécifiques qui pourraient être en jeu ici et pour élucider le parcours de traitement le plus approprié et le plus efficace.
Contributions de l’auteur
RE a examiné les dossiers des patients et l’imagerie, a recueilli les données et a construit les présentations préliminaires, tout en contribuant à l’édition en cours du manuscrit final soumis. OW a supervisé RE dans la collecte des données et a participé à tous les niveaux de la rédaction et de l’interprétation des données ainsi qu’à la révision et à l’édition du manuscrit final ci-dessous. AB a travaillé avec RE dans l’analyse des données, la revue de la littérature pertinente, l’interprétation des résultats et la préparation du manuscrit.
Déclaration de conflit d’intérêts
Cette recherche n’a été soutenue financièrement par aucun intérêt commercial. Il n’existe aucune relation financière qui pourrait être interprétée comme un conflit d’intérêts potentiel.
1. Milea D, Napolitano M, Dechy H, Le Hoang P, Delattre J-Y, Pierrot-Deseilligny C. Complete bilateral horizontal gaze paralysis disclosing multiple sclerosis. J Neurol Neurosurg Psychiatry (2001) 70(2):252-5. doi:10.1136/jnnp.70.2.252
PubMed Abstract | CrossRef Full Text | Google Scholar
2. Tan E, Kansu T. Bilateral horizontal gaze palsy in multiple sclerosis. J Clin Neuroophthalmol (1990) 10(2):124–6.
Google Scholar
3. Kataoka S, Hori A, Shirakawa T, Hirose G. Paramedian pontine infarction. Stroke (1997) 28(4):809–15. doi:10.1161/01.STR.28.4.809
CrossRef Full Text | Google Scholar
4. Furutani Y, Hata M, Miyamoto K, Moribata Y, Yoshimura N. A case of neuromyelitis optica masquerading as Miller Fisher syndrome. Case Rep Neurol (2014) 6(3):226–31. doi:10.1159/000368183
PubMed Abstract | CrossRef Full Text | Google Scholar
5. Ng AW, Teoh SC. Dengue eye disease. Surv Ophthalmol (2015) 60(2):106–14. doi:10.1016/j.survophthal.2014.07.003
PubMed Abstract | CrossRef Full Text | Google Scholar
6. Koehler PJ, Wattendorff AR, Goor C, Hekster REM, Falke THM. Bilateral horizontal gaze paralysis due to pontine hemorrhage. Clin Neurol Neurosurg (1986) 88(2):121–5. doi:10.1016/S0303-8467(86)80007-5
CrossRef Full Text | Google Scholar
7. Pierrot-Deseilligny C, Goasguen J, Chain F, Lapresle J. Pontine metastasis with dissociated bilateral horizontal gaze paralysis. J Neurol Neurosurg Psychiatry (1984) 47(2):159–64. doi:10.1136/jnnp.47.2.159
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Henderson S. A young patient with visual disturbance. Eur J Intern Med (2014) 25(6):e69–70. doi:10.1016/j.ejim.2014.05.007
CrossRef Full Text | Google Scholar
9. Matsui TA, Mineta H, Shioyama S, Kihara M, Takahashi M. . Clin Neurol (1998) 38(2):150–3.
Google Scholar
10. Bickerstaff ER. Brain-stem encephalitis; further observations on a grave syndrome with benign prognosis. Br Med J (1957) 1(5032):1384–7. doi:10.1136/bmj.1.5032.1384
CrossRef Full Text | Google Scholar
11. Schaefer PW, Grant PE, Gonzalez RG. Diffusion-weighted MR imaging of the brain. Radiology (2000) 217(2):331–45. doi:10.1148/radiology.217.2.r00nv24331
CrossRef Full Text | Google Scholar
12. Küker W, Ruff J, Gaertner S, Mehnert F, Mader I, Nägele T. Modern MRI tools for the characterization of acute demyelinating lesions : value of chemical shift and diffusion-weighted imaging. Neuroradiology (2004) 46(6):421-6. doi:10.1007/s00234-004-1203-5
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Kipfer S, Crook DW. Paralysie bilatérale isolée du regard horizontal comme première manifestation de la sclérose en plaques. Mult Scler J (2014) 20(6):754-5. doi:10.1177/1352458513518627
CrossRef Full Text | Google Scholar
14. Bronstein AM, Rudge P, Gresty MA, Du Boulay G, Morris J. Abnormalities of horizontal gaze. Résultats cliniques, oculographiques et d’imagerie par résonance magnétique. II. Gaze palsy and internuclear ophthalmoplegia. J Neurol Neurosurg Psychiatry (1990) 53(3):200–7. doi:10.1136/jnnp.53.3.200
CrossRef Full Text | Google Scholar
15. Wingerchuk DM, Lennon VA, Pittock SJ, Lucchinetti CF, Weinshenker BG. Revised diagnostic criteria for neuromyelitis optica. Neurology (2006) 66(10):1485–9. doi:10.1212/01.wnl.0000216139.44259.74
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Wingerchuk DM, Banwell B, Bennett JL, Cabre P, Carroll W, Chitnis T, et al. International consensus diagnostic criteria for neuromyelitis optica spectrum disorders. Neurology (2015) 85:177–89. doi:10.1212/WNL.0000000000001729
CrossRef Full Text | Google Scholar
17. Kira J. The expanding phenotype of CLIPPERS: is it a disease or a syndrome? J Neurol Neurosurg Psychiatry (2012) 83(1):2–3. doi:10.1136/jnnp-2011-301626
CrossRef Full Text | Google Scholar
18. Henn V, Lang W, Hepp K, Reisine H. Experimental gaze palsies in monkeys and their relation to human pathology. Brain (1984) 107(2):619–36. doi:10.1093/brain/107.2.619
PubMed Abstract | CrossRef Full Text | Google Scholar
19. Büttner-Ennever JA, Buttner U. A cell group associated with vertical eye movements in the rostral mesencephalic reticular formation of the monkey. Brain Res (1978) 151(1):31–47. doi:10.1016/0006-8993(78)90948-4
PubMed Abstract | CrossRef Full Text | Google Scholar
20. Horn AKE. The reticular formation. Prog Brain Res (2006) 151:127–55. doi:10.1016/S0079-6123(05)51005-7
CrossRef Full Text | Google Scholar
21. Nakao S, Shiraishi Y, Oda H, Inagaki M. Direct inhibitory projection of pontine omnipause neurons to burst neurons in the Forel’s field H controlling vertical eye movement-related motoneurons in the cat. Exp Brain Res (1988) 70(3):632–6. doi:10.1007
CrossRef Full Text | Google Scholar
22. Bender MB. Brain control of conjugate horizontal and vertical eye movements: a survey of the structural and functional correlates. Brain (1980) 103(1):23–69. doi:10.1093/brain/103.1.23
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Ranalli PJ, Sharpe JA. Vertical vestibulo-ocular reflex, smooth pursuit and eye-head tracking dysfunction in internuclear ophthalmoplegia. Brain (1988) 111(Pt 6):1299–317.
PubMed Abstract | Google Scholar
24. Bhidayasiri R, Plant GT, Leigh RJ. A hypothetical scheme for the brainstem control of vertical gaze. Neurology (2000) 54(10):1985–93.
PubMed Abstract | Google Scholar