H2S Lewis Structure, Molecular Geometry, Hybridization and Polarity
Hydrogen Sulfide is a common chemical compound that is useful for analyzing inorganic compounds of metal ions. It has the chemical formula of H2S. The molecule has two Hydrogen atoms and a single Sulfur atom. H2S is also a precursor for elemental Sulfur. It also plays a vital role in signaling pathways in the human body. So to understand the hybridization, polarity, and molecular geometry of this compound, it is essential to know its Lewis structure.
| Name of molecule | Hydrogen Disulfide ( H2S) |
| No of Valence Electrons in the molecule | 8 |
| Hybridization of CO2 | sp3 hybridization |
| Bond Angles | 104.5 degrees |
| Molecular Geometry of CO2 | Bent |
Before knowing its Lewis structure, let us calculate the total number of valence electrons in Hydrogen Sulfide as these electrons participate in bond formation and help us study Lewis structure with ease.
Contents
Valence electrons of H2S
To know the total number of valence electrons in Hydrogen Sulfide we need to add the valence electrons of both Hydrogen and Sulfur atoms. There are two atoms of Hydrogen and a single atom of Sulfur in the compound.
Each Hydrogen atom has only one electron which is also its valence electron
Hence there are two valence electrons for Hydrogen atom ( as there are two Hydrogen atoms)
Sulfur has six valence electrons.
Total number of valence electrons in H2S
= 2(1) + 6
= 8
Thus, there are a total of eight valence electrons in H2S.
Structure de Lewis de H2S
La structure de Lewis de tout composé est une représentation structurelle des électrons de valence participant à la formation de la liaison ainsi que des paires d’électrons non liants. Connaître la structure de Lewis d’un composé chimique donné est essentiel car elle fournit les informations nécessaires sur toutes les autres propriétés chimiques du composé.
La représentation est affichée à l’aide de points et de lignes qui représentent les électrons. Les points représentent les électrons qui ne participent pas à la formation des liaisons. Tandis que les lignes représentent les liaisons dans le composé. La structure est réalisée sur la base de la règle de l’octuor. La règle de l’octet en chimie stipule qu’il doit y avoir huit électrons dans la coquille extérieure d’un élément pour qu’il soit stable.
La structure de Lewis du sulfure d’hydrogène est facile à dessiner et à comprendre. Dans ce composé, les deux atomes d’hydrogène ont besoin d’un électron pour établir la liaison covalente avec le soufre. La structure de Lewis du H2S est similaire à celle du H2S. Le soufre a besoin de huit électrons pour remplir les conditions de la règle de l’octuple. Mais l’hydrogène n’a besoin que d’un seul électron pour devenir stable car il appartient aux éléments du groupe 1.
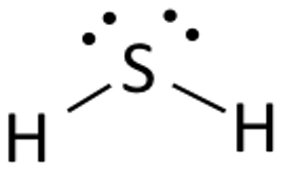
Placez l’atome de soufre au milieu et disposez ses électrons de valence autour de lui.
Maintenant, placez deux atomes d’Hydrogène de part et d’autre de l’atome central.
Ici, les électrons de valence du Soufre sont utilisés pour rendre l’Hydrogène stable en donnant un électron aux deux atomes d’Hydrogène. Deux électrons de valence sur six participent à la formation des liaisons.
Dessinez des lignes ( pour montrer les liaisons) entre les atomes d’Hydrogène et de Soufre.
Les quatre électrons restants sont des électrons non liants et sont donc représentés par des points près de l’atome de soufre. Au total, il y a deux paires d’électrons non liants dans ce composé et les atomes d’Hydrogène ont une coquille de valence complète.
Hydratation de l’H2S
Pour comprendre l’hybridation de l’H2S, il est essentiel de connaître d’abord deux choses :
- Le nombre de liaisons dans le composé et son type
Il est essentiel de connaître le type de liaison dans le composé pour connaître son hybridation. Dans la molécule H2S, deux atomes d’hydrogène forment une liaison avec l’atome de soufre central. Deux liaisons simples sont formées dans la molécule. Ces liaisons occupent quatre électrons de valence, et il reste donc quatre autres électrons de valence. En formant une liaison, l’orbitale s de l’atome d’hydrogène chevauche l’orbitale p de l’atome de soufre. La paire d’électrons solitaires occupe deux des orbitales sp3. Les deux autres orbitales de sp3 chevauchent l’orbitale 1s de l’atome d’hydrogène.
Cet arrangement conduit à l’hybridation sp3 de la molécule H2S. Le chevauchement des deux orbitales hybrides forme deux liaisons sigma entre l’hydrogène et l’atome de soufre.
- Le nombre stérique du composé donné
Le nombre stérique est défini comme la région de densité électronique observée autour de l’atome central. Dans ce cas, le soufre étant l’atome central, le nombre stérique du composé sera le total cumulé des atomes liés à l’atome central et le nombre de paires d’électrons solitaires autour de l’atome central.
La formule pour trouver ce nombre est :
Nombre stérique (SN)
= Nb de liaisons sigma sur l’atome central +Nb de paires d’électrons solitaires pi sur l’atome central
Dans ce cas des molécules H2S, il y a deux liaisons sigma, et il y a deux paires d’électrons solitaires sur l’atome central.

Donc SN de la molécule H2S = 2+2
=4
Comme le nombre stérique de H2S est de quatre, il possède deux
orbitales hybrides et deux paires d’électrons solitaires qui en font une hybridation sp3.
Maintenant que nous connaissons la structure de Lewis et l’hybridation de la molécule, il est facile de déterminer sa géométrie moléculaire.
Géométrie moléculaire de H2S
L’hybridation de la molécule donnée H2S est sp3 ; l’atome de soufre est en liaison centrale avec deux atomes d’hydrogène formant l’angle de liaison inférieur à 180 degrés. Selon la théorie VSEPR, les paires d’électrons solitaires se repoussent, mais comme l’atome de soufre est moins électronégatif, l’angle de liaison diminue à 104,5 degrés.
Cette diminution de l’angle conduit à une structure coudée.
Une autre façon de connaître la géométrie moléculaire est la méthode AXN. Où A désigne l’atome central, X est pour le nombre de paire d’électrons liés et N est pour la paire d’électrons solitaires. Ici, la formule générale sera AX2N2 en raison de deux paires de liaisons et de deux paires d’électrons solitaires. Ainsi, cette molécule présente une géométrie coudée.
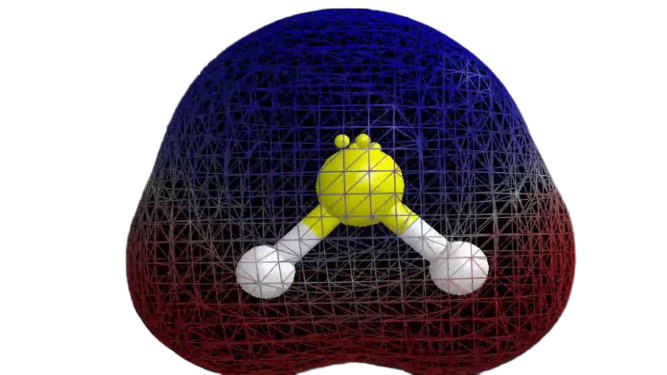
Polarité de H2S
Maintenant que nous avons les informations requises sur la molécule, il est facile de déterminer sa polarité. La polarité d’une molécule donnée dépend de sa géométrie moléculaire et de l’électronégativité globale. L’atome de soufre étant moins électronégatif, l’électronégativité globale du composé est inférieure à 0,4, ce qui le rend non polaire.
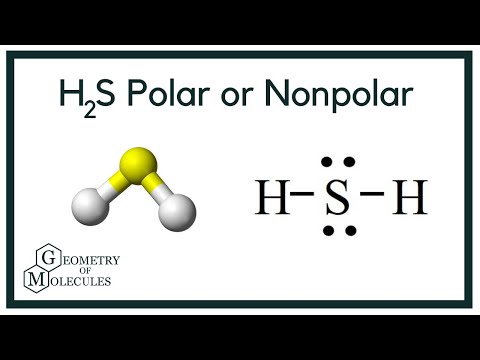
On peut donc dire que la molécule H2S est non polaire.
Marques de conclusion
D’après les informations ci-dessus, on peut conclure que la molécule H2S possède huit électrons de valence, une hybridation sp3, une géométrie moléculaire courbée et qu’elle est non polaire.