La goutte : Facteurs de risque, diagnostic et traitement
La goutte peut être extrêmement douloureuse et invalidante, mais elle est extrêmement traitable chez presque tous les patients. Il est important de l’identifier et de la traiter rapidement pour éviter la douleur et les complications. La goutte est un problème majeur au niveau du pied, mais elle peut également toucher de nombreuses autres articulations.
- Introduction
- Qui souffre de la goutte et pourquoi ?
- Quelles articulations sont concernées par l’arthrite goutteuse, et pourquoi est-elle plus fréquente au niveau du pied ?
- À quoi ressemble et comment se sent une crise de goutte ? A quoi ressemblerait un pied ou un orteil atteint de goutte ?
- Comment la goutte est-elle diagnostiquée ?
- Comment peut-on traiter une crise de goutte ?
- Comment peut-on prévenir une crise de goutte ?
- Quand la chirurgie est-elle envisagée pour la goutte ?
- Quels sont les futurs traitements possibles de la goutte ?
- Résumé
- Divulgations
- Plus d’informations
Introduction
La goutte est une maladie ancienne associée à des dépôts d’acide urique, notamment dans les articulations et les reins.
Les Égyptiens ont identifié une douleur locale du pied, au niveau du gros orteil, comme une maladie spécifique en 2640 avant notre ère, avant que le mot » goutte » ne soit utilisé. Elle a été décrite par Hippocrate, qui a noté son rapport élevé entre hommes et femmes et son association avec l’alcool. Le Dr Thomas Sydenham (1624-1689) a décrit les amas d’acide urique (appelés tophi) que l’on peut observer dans la goutte, en se basant sur sa propre souffrance. Jusqu’au début du 19e siècle, cependant, la goutte n’était pas bien séparée des autres types d’arthrite inflammatoire. Ce n’est qu’au 20e siècle que les voies de production de l’acide urique dans l’organisme ont été clarifiées, et que la capacité des cristaux d’acide urique à produire une inflammation articulaire a été prouvée.
La goutte peut être extrêmement douloureuse et invalidante, mais elle est extrêmement traitable chez presque tous les patients. Elle se manifeste le plus souvent au niveau du gros orteil, mais aussi au niveau du médio-pied, de la cheville et du genou. (Voir le point 3 ci-dessous pour plus de détails sur la façon dont la goutte concerne ces articulations et d’autres.)
Il est important de l’identifier et de la traiter rapidement pour éviter la douleur et les complications. Les femmes ne sont pas exemptes du risque de goutte et commencent à « rattraper » les hommes après la ménopause.
Bien que l’alcool puisse provoquer des crises de goutte, la génétique est beaucoup plus importante que l’alcool pour définir qui est atteint de goutte, et beaucoup de personnes qui ne boivent jamais d’alcool souffrent de goutte. En fait, on pense que les familles royales françaises qui souffraient de la goutte ont développé cette affection davantage à cause de l’empoisonnement au plomb des fûts utilisés pour leur vin que du vin lui-même, car le plomb blesse les reins et altère leur capacité à éliminer l’acide urique du système. Cette situation a été reproduite à une époque plus récente, lorsque des buveurs de « moonshine whiskey », souvent fabriqué dans des radiateurs contenant du plomb, ont développé une goutte associée au saturnisme (« goutte saturnienne »). L’excès de poids corporel a également été associé à la goutte. Le bourgeois prospère et en surpoids souffrant de la goutte est une image européenne classique du 19e siècle, mais en réalité, la goutte touche les personnes de toutes les classes économiques.
La goutte est une maladie courante. On a estimé qu’il pourrait y avoir jusqu’à cinq millions de personnes souffrant de la goutte aux États-Unis. Des estimations encore plus prudentes évaluent ce nombre à plus de deux millions (estimation de la Mayo Clinic). Des études de population menées à la fois par la Mayo Clinic et par Taïwan ont montré une augmentation significative de la prévalence de la goutte récemment par rapport au début des années 1990.
La prévalence de la goutte a augmenté à la fois chez les personnes âgées et les jeunes. L’augmentation chez les plus jeunes n’est pas expliquée, mais l’augmentation chez les personnes âgées, au moins en partie, est liée à l’augmentation de la durée de vie, à l’augmentation du poids (l’obésité est associée à la goutte) et à l’utilisation accrue de diurétiques. Les diurétiques sont utilisés couramment pour l’hypertension, par exemple, et ils élèvent les taux sanguins d’acide urique et peuvent augmenter le risque de goutte.
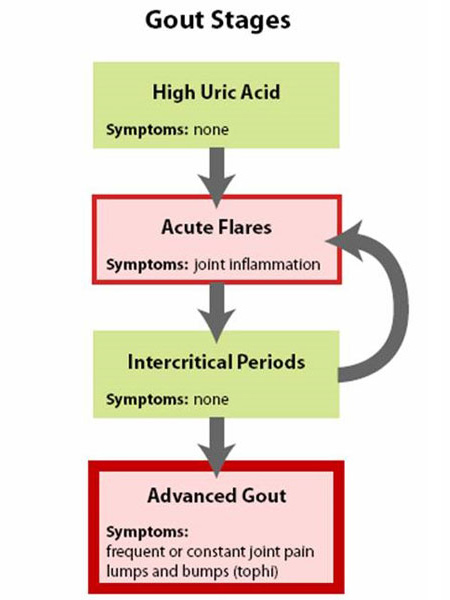
Figure 1 : Stades de la goutte
![]()
![]()
Figure 2A et B : Orteil normal (A) et orteil avec tophus goutteux (B)
La meilleure façon de comprendre la goutte est de la considérer comme comportant quatre stades (figure 1 : stades de la goutte).
- La première phase correspond à une élévation de l’acide urique sans goutte ni calcul rénal, une phase qui ne présente aucun symptôme et qui n’est généralement pas traitée.
- La deuxième phase est la « crise aiguë » – avec douleur et inflammation.
- La troisième phase est le « temps entre les crises », lorsque la personne se sent normale mais risque de récidiver.
- La dernière phase est celle de » l’arthrite goutteuse chronique « , où l’on trouve des » grumeaux » d’acide urique, ou tophi (Figure 2a et 2b : illustration d’une articulation normale de l’orteil et de tophus goutteux), des crises fréquentes de goutte aiguë et souvent un degré de douleur même entre les crises (Figure 3 : progression de la goutte).
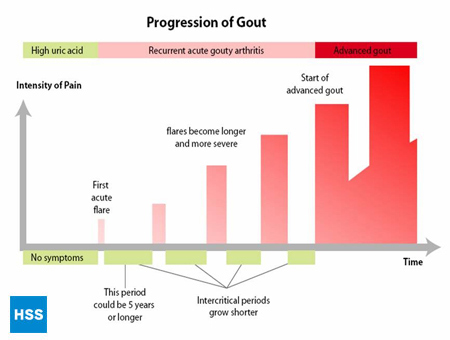
Figure 3 : progression de la goutte
(Retour en haut de l’article)
Qui souffre de la goutte et pourquoi ?
La goutte est clairement associée à une accumulation d’acide urique. L’acide urique est un produit dans le cadre du métabolisme de l’organisme des purines, qui sont produites lorsque l’organisme décompose l’une des nombreuses substances contenant de la purine, y compris les acides nucléiques provenant de notre alimentation ou de la décomposition de nos propres cellules.
La figure 4, sur le côté gauche, montre une voie simplifiée des purines à l’acide urique, et sur la droite montre comment les médicaments contre la goutte fonctionnent, ce qui est discuté plus en détail dans les sections 5 et 6 ci-dessous (Figure 4 : Voie des purines à l’acide urique). Selon le laboratoire, les valeurs normales d’acide urique vont de 3,6 mg/dL à 8,3 mg/dL. Plus le taux sanguin d’acide urique est élevé, plus le risque de dépôts d’acide urique dans les articulations et de crises de goutte ultérieures est important.
Chez les mammifères autres que l’homme et les grands singes, l’enzyme uricase décompose l’acide urique en allantoïne, plus soluble, qui peut être plus facilement excrétée dans l’urine. L’homme, dépourvu de cette enzyme, présente des taux d’acide urique plus élevés et est donc sujet à la goutte.
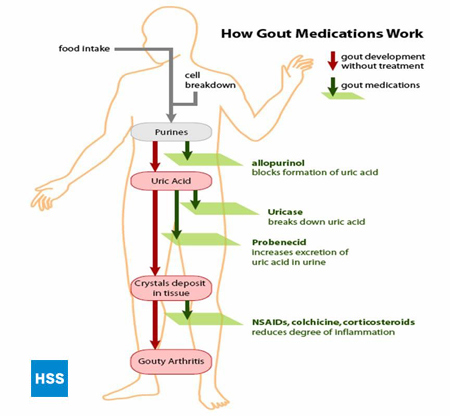
Figure 4 : Voie des purines vers l’acide urique
La goutte peut se développer chez une personne soit parce qu’elle produit trop d’acide urique, soit parce qu’elle ne parvient pas à en éliminer suffisamment dans l’urine (ou les deux). La cause la plus fréquente de la goutte (environ 90 % des cas) est l’incapacité à excréter suffisamment d’acide urique dans l’urine. Cette incapacité peut se produire pour un certain nombre de raisons. La plus fréquente est un défaut génétique dans des substances appelées transporteurs d’anions organiques dans le rein, qui entraîne une réabsorption excessive d’acide urique par le rein – et donc un excès d’acide urique dans le sang. Toutefois, un défaut d’excrétion de l’acide urique peut également être dû à des médicaments, tels que les diurétiques, l’aspirine à faible dose ou l’alcool. Un défaut d’excrétion de l’acide urique se produit également lorsque les reins fonctionnent mal.
Environ 10 % des cas de goutte sont dus à une surproduction d’acide urique. Lorsque l’acide urique est surproduit, il est élevé non seulement dans le sang mais aussi dans l’urine, ce qui augmente le risque à la fois de goutte et de calculs rénaux. Certaines personnes surproduisent de l’acide urique en raison d’un défaut génétique d’une enzyme dans la voie de dégradation des purines (voir figure 4) qui entraîne une suractivité de cette voie. Comme les cellules contiennent de l’ADN, et que l’ADN contient des purines, tout ce qui augmente la dégradation des cellules dans l’organisme peut entraîner une augmentation de l’acide urique et de la goutte. Par exemple, si un patient reçoit une chimiothérapie pour une tumeur, au fur et à mesure que le traitement tue les cellules tumorales, une crise de goutte ou un calcul rénal peut se développer en raison de la dégradation des purines de ces cellules.
Les aliments peuvent également conduire à une surproduction d’acide urique, comme les viandes et les sauces à base de viande et la bière, qui contiennent des niveaux élevés de purines.
Les hommes ont la goutte plus souvent que les femmes, et à un âge plus jeune ; le ratio homme/femme est de 9:1. L’âge le plus fréquent d’apparition de la maladie se situe entre 40 et 60 ans. La goutte est assez rare chez les femmes jusqu’à ce qu’elles atteignent la ménopause. Une théorie veut que les œstrogènes bloquent le transporteur d’échange d’anions (voir ci-dessus) dans le rein, ce qui entraîne une augmentation de l’excrétion d’acide urique dans l’urine, et donc une diminution du taux d’acide urique dans le sang. La goutte se déclare le plus souvent entre 40 et 60 ans, bien qu’elle puisse commencer plus tôt que la quarantaine pour les personnes ayant une prédisposition génétique, et elle peut également se manifester pour la première fois lorsqu’une personne a 80 ans.
Dans certains cas, des blessures peuvent déclencher une crise de goutte. Un « coup d’orteil » peut entraîner une crise de goutte s’il y avait déjà suffisamment de cristaux d’acide urique saturant le cartilage.
Quel que soit le mécanisme de l’élévation de l’acide urique, l’événement clé de la goutte est le déplacement des cristaux d’acide urique dans le liquide articulaire. Les mécanismes de défense de l’organisme, notamment les globules blancs (neutrophiles), engloutissent les cristaux d’acide urique, ce qui entraîne une libération de substances chimiques inflammatoires (appelées cytokines) qui provoquent tous les signes d’inflammation, notamment la chaleur, la rougeur et le gonflement, ainsi que la douleur. Ce cycle recrute également davantage de globules blancs dans l’articulation, ce qui accélère le processus inflammatoire.
Lorsqu’on pense à la goutte, un modèle utile a été proposé par Wortmann.1 Les cristaux d’acide urique peuvent être considérés comme des allumettes, qui peuvent rester tranquilles ou être allumées. Les cristaux peuvent être présents pendant des années dans le cartilage, ou même dans le liquide articulaire, sans provoquer d’inflammation. Puis, à un moment donné, en raison de l’augmentation du nombre de cristaux ou d’un autre facteur incitatif, les allumettes sont « craquées » et l’inflammation commence. Cette analogie est importante à la fois pour conceptualiser les cristaux d’acide urique dans l’articulation et pour comprendre les différents types de traitement de la goutte (voir ci-dessous), dont certains s’attaquent à l’inflammation (verser de l’eau sur les allumettes enflammées) et d’autres éliminent les cristaux d’acide urique (enlever les allumettes).
(Retour en haut de l’article)
Quelles sont les articulations concernées par l’arthrite goutteuse, et pourquoi est-elle plus fréquente au pied ?
Comme tous les autres types d’arthrite connus, la goutte a des articulations particulières qu’elle a tendance à attaquer, et le pied est la localisation la plus courante de la goutte. La goutte favorise particulièrement l’articulation de l’oignon, connue sous le nom de 1ère articulation métatarsophalangienne, qui est la première articulation touchée chez 75 % des patients et qui est finalement touchée chez plus de 90 % des personnes atteintes de cette affection. (Figure 5 : Localisation des crises de goutte). On pense que cette articulation est particulièrement touchée par la goutte parce que c’est celle qui subit la pression la plus élevée par pouce carré lors de la marche ou de la course. La cheville, le médio-pied et le genou sont également des endroits fréquemment touchés par la goutte, de même que la bourse qui recouvre le coude. À un stade avancé de la goutte, si elle n’est pas traitée, plusieurs articulations peuvent être touchées, notamment les doigts et les poignets. L’articulation de l’épaule est très rarement touchée par la goutte et la hanche essentiellement jamais.
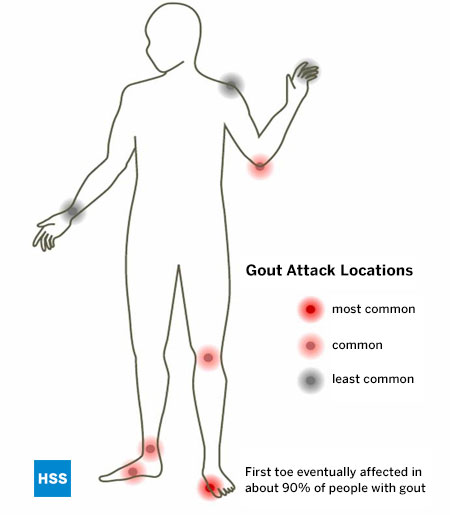
Figure 5 : Localisation des crises de goutte
À quoi ressemble et comment se sent une crise de goutte ? À quoi ressemblerait un pied ou un orteil atteint de goutte ?
Lorsque la goutte survient, l’articulation a tendance à être extrêmement douloureuse et est chaude, rouge et gonflée (figure 6 : Orteil avec crise aiguë de goutte). L’inflammation qui fait partie d’une crise de goutte est systémique, de sorte qu’il n’est pas rare que la fièvre et les frissons, la fatigue et le malaise fassent partie du tableau d’une crise de goutte.
![]()
Figure 6 : Orteil avec une crise aiguë de goutte
Les crises de goutte peuvent survenir dans des articulations d’apparence normale, ou dans des articulations qui présentent des dépôts d’acide urique facilement visibles. Ces dépôts sont appelés tophi (Voir Figures : 7a et 7b : Tophi sur le pied et au-dessus du tendon d’Achille, Figure 8 : Tophus sur le coude, Figure 9 : Tophi sur les mains, et Figure 10 : Gros tophus du doigt) et peuvent se trouver à de nombreux endroits, mais surtout sur les pieds et les coudes. Sur la figure 9, l’auriculaire de la main droite est bandé car on vient d’y prélever du liquide qui a mis en évidence d’innombrables cristaux d’acide urique.
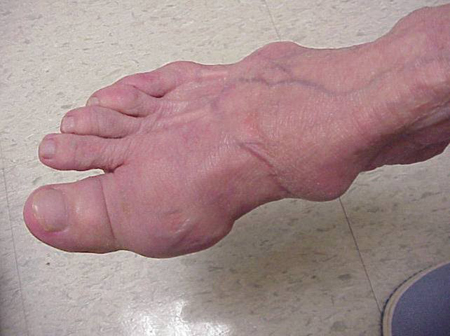
Figure 7a : Tophi sur un pied
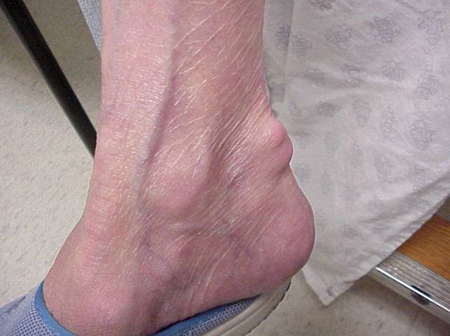
Figure 7b : Tophus sur le tendon d’Achille
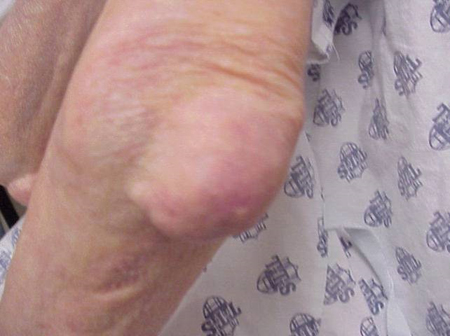
Figure 8 : Tophus sur le coude
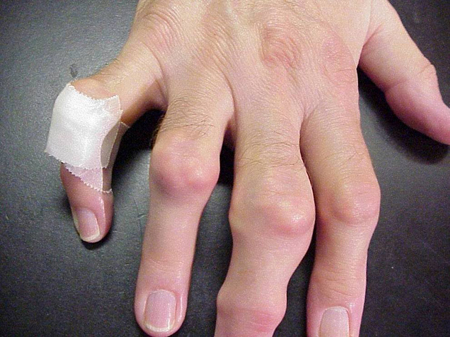
Figure 9 : Tophi sur les mains
![]()
Figure 10 : Gros tophus d’un doigt
Si certaines crises de goutte se résolvent rapidement d’elles-mêmes, la majorité d’entre elles durent une semaine, plusieurs semaines, voire plus si elles ne sont pas traitées. Comme les crises de goutte sont généralement assez douloureuses et rendent souvent la marche difficile, la plupart des goutteux demanderont un traitement spécifique pour leur affection douloureuse.
(Retour en haut de l’article)
Comment diagnostiquer la goutte ?
Comme le traitement de la goutte dure toute la vie, il est très important de poser un diagnostic définitif. Dans un cas bien défini, un médecin de soins primaires peut poser le diagnostic de la goutte avec un haut niveau de confiance, mais il y a souvent deux ou plusieurs causes possibles pour un orteil enflammé ou une autre articulation qui présente certaines des caractéristiques de la goutte.
En principe, le diagnostic est posé en identifiant des cristaux d’acide urique dans le liquide articulaire ou dans une masse d’acide urique (tophus). Ceux-ci peuvent être vus en mettant une goutte de liquide sur une lame et en l’examinant à l’aide d’un microscope polarisant, qui tire parti de la façon dont les cristaux d’acide urique courbent la lumière. Un non-rhumatologue peut, dans la mesure du possible, prélever du liquide dans l’articulation en l’aspirant avec une petite aiguille et l’envoyer à un laboratoire pour analyse. Un rhumatologue est susceptible d’avoir un accessoire polarisant sur son microscope à son cabinet. Les cristaux de goutte ont une forme d’aiguille, et sont soit jaunes, soit bleus, selon la façon dont ils sont disposés sur la lame (voir la figure 11 : cristaux d’acide urique sous microscope à lumière polarisée).
![]()
Figure 11 : Cristaux d’acide urique sous microscope à lumière polarisée
Il existe de nombreuses circonstances où, aussi idéal que cela puisse être, aucun fluide ou autre spécimen n’est disponible pour être examiné, mais un diagnostic de goutte doit être posé. Un ensemble de critères a été établi pour aider à poser le diagnostic de la goutte dans ce contexte (voir Tableau 1- Diagnostic de la goutte lorsqu’aucune identification des cristaux n’est possible).2
Ces critères tirent parti des caractéristiques de la goutte qui la distinguent des autres types d’arthrite inflammatoire, comme la polyarthrite rhumatoïde. Par exemple, l’inflammation de la goutte tend à atteindre un maximum dans les 24 heures, alors que les autres types d’arthrite ont tendance à évoluer plus lentement. De même, la présence d’une rougeur sur une articulation, l’implication de l’articulation « oignon » et un taux sanguin élevé d’acide urique sont autant de caractéristiques qui rendent la goutte plus probable. Le diagnostic de goutte est posé en présence de 6 des 10 critères énumérés dans le tableau 1.
Tableau 1 : Diagnostiquer la goutte lorsqu’aucune identification de cristaux n’est possible
Idéalement, 6 des 10 caractéristiques suivantes seront présentes :
- L’inflammation atteint un maximum dans la journée (accélération rapide de l’inflammation).
- Avoir des antécédents d’un épisode d’inflammation similaire
- Attaque d’arthrite dans une seule articulation.
- Rougeur sur une articulation impliquée (la goutte est très inflammatoire)
- Introduction de la base du gros orteil d’un côté (site le plus fréquent pour la goutte)
- Introduction des articulations du milieu du pied
- Élévation de l’acide urique dans les analyses sanguines
- Les radiographies révèlent un gonflement des articulations qui n’est pas symétrique
- Le liquide articulaire est testé pour une infection et est négatif.
- La radiographie montre des changements caractéristiques de la goutte, notamment des kystes dans l’os et des érosions.
Lorsque le diagnostic de goutte est posé, la personne doit être évaluée pour les complications de la goutte :
- Il faut rechercher des collections d’acide urique (tophi), qui peuvent se trouver à de nombreux endroits (voir figures 7-10).
- Il faut s’enquérir des antécédents de calculs rénaux, car un patient atteint de goutte et de calculs rénaux nécessitera probablement une diminution plus rapide et plus agressive de l’acide urique (voir ci-dessous) qu’un patient sans calculs, pour essayer de prévenir la formation récurrente de calculs.
- Il a été démontré dans un large éventail d’études qu’un patient souffrant de goutte présente un risque plus élevé de maladie coronarienne, et devrait subir une évaluation appropriée au risque coronarien (par exemple, des tests de laboratoire pour le taux de cholestérol et de triglycérides).3
Il est important que les dommages aux os causés par la goutte soient diagnostiqués, car des dommages documentés sont une indication claire pour un traitement à long terme (voir ci-dessous). Une fois que les dommages ont commencé, il est important de réduire le taux total d’acide urique dans le corps, ce qui, par équilibrage, fait sortir l’acide urique des articulations. En effet, les taux d’acide urique dans le sang et les articulations atteignent un certain niveau, appelé « état d’équilibre », à un taux d’acide urique sanguin donné. Si le taux sanguin est réduit, le taux articulaire d’acide urique diminuera progressivement lui aussi. Cela conduit à ce que les crises de goutte diminuent ou cessent complètement avec le temps, et à ce que les tophi soient réabsorbés et rétrécissent ou disparaissent complètement.
Différentes approches peuvent être adoptées pour abaisser l’acide urique total du corps. On peut diminuer la production d’acide urique dans l’organisme (par exemple, par l’allopurinol, voir ci-dessous) ou augmenter l’excrétion d’acide urique (par exemple, par le probénécide, voir ci-dessous). Les cristaux peuvent également être décomposés dans l’organisme (voir 7a ci-dessous, re : Rasburicase, et 7b ci-dessous, re : uricase pégylée), mais l’utilisation de ce mécanisme est encore à l’étude à l’heure actuelle. Cela peut aider à prévenir des dommages supplémentaires.
Les rayons X sont la technique d’imagerie standard pour la goutte (voir les figures 12-17 : Figure 12 : Goutte de la base du 1er orteil ; Figure 13 : Goutte des articulations distales des doigts ; Figure 14 : Changement goutteux et calcification des tissus mous autour de la base du 1er orteil ; Figure 15 : Destruction goutteuse au niveau de plusieurs articulations des doigts ; Figure 16 : Érosion goutteuse au niveau de l’ulna proximal au coude ; Figure 17 : Grand tophus vu comme une masse de tissu mou au coude) mais dans des cas particuliers, comme lorsque la goutte doit être séparée d’une infection ou d’une tumeur, l’imagerie par résonance magnétique (IRM) (Figure 18 : IRM du genou montrant une masse de tissu mou goutteuse et une érosion de la rotule) ou l’échographie (Figure 19 : Étude Doppler de puissance montrant une inflammation goutteuse à la base du 1er orteil) seront utiles.
![]()
Figure 12 : Gout of the Base of the 1st Toe
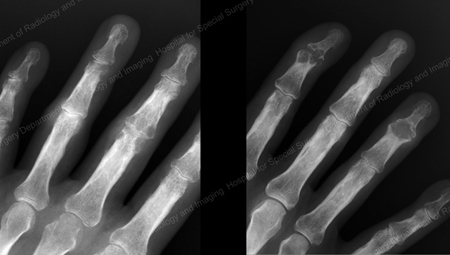
Figure 13: Gout of the Distal Finger Joints
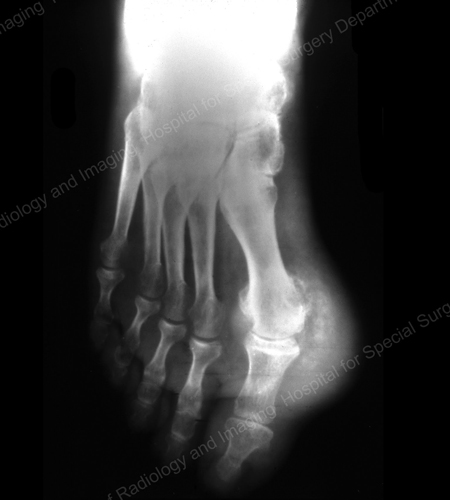
Figure 14: Gouty Change and Soft Tissue Calcification about the Base of the 1st Toe
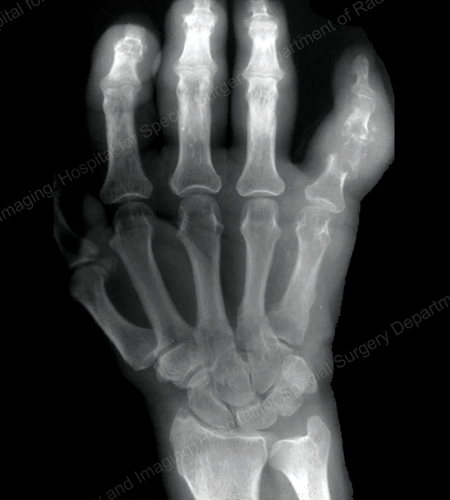
Figure 15: Gouty Destruction at Multiple Finger Joints
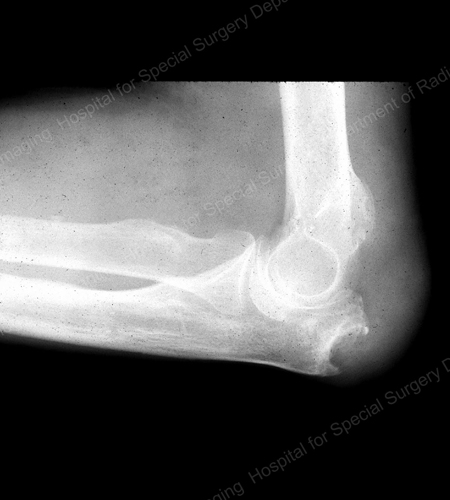
Figure 16: Gouty Erosion at the Proximal Ulna at the Elbow
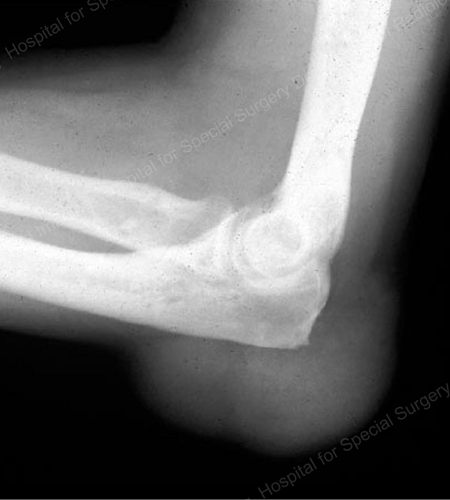
Figure 17: Grand tophus vu comme une masse de tissu mou au coude
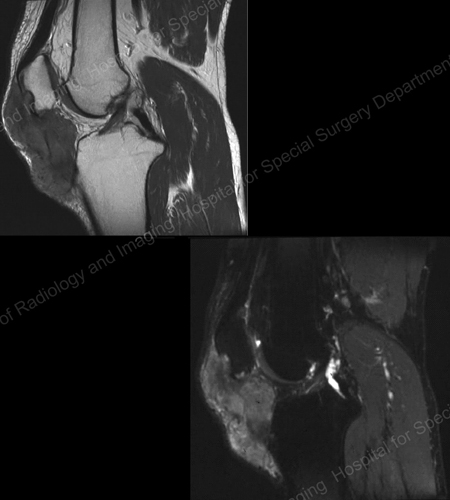
Figure 18 : IRM du genou montrant une masse de tissu mou goutteux et une érosion de la rotule
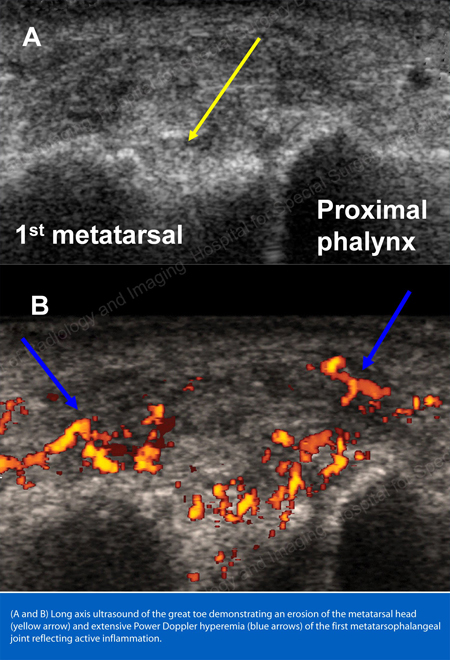
Figure 19 : Étude Power Doppler montrant une inflammation goutteuse à la base du 1er orteil
Les articulations rouges et chaudes, associées à une accélération rapide de la douleur articulaire, suggèrent fortement la goutte, et l’identification des tophi, s’ils sont présents (voir figures 7-10) aident davantage.
Un effort particulier doit être fait pour distinguer la goutte des autres types d’arthrite induits par les cristaux. Par exemple, la pseudogoutte, causée par un type différent de cristal (pyrophosphate de calcium), provoque le même type d’articulation chaude et rouge, et la même accélération rapide de la douleur que la goutte. La pseudogoutte peut être distinguée par la présence de dépôts de calcium dans les articulations sur les radiographies, qui se déposent d’une manière différente de celle de la goutte. Lorsqu’on examine le liquide provenant d’une articulation enflammée dans la pseudogoutte, on peut voir le cristal causal spécifique.
Un troisième type d’arthrite induite par les cristaux, la maladie des dépôts d’hydroxyapatite, présente un type de cristal qui nécessite des études spéciales (l’une de ces études est la microscopie électronique) pour être identifié. La présence de ces autres types d’inflammation liée aux cristaux souligne encore plus l’intérêt d’identifier les cristaux d’acide urique comme la cause de l’arthrite d’un patient particulier, chaque fois que cela est possible, afin de s’assurer que l’on traite la bonne pathologie.
(Retour au début de l’article)
Comment traiter une crise de goutte ?
La prise en charge d’une crise aiguë de goutte est très différente de la prévention des crises ultérieures. Voir la figure 4 pour l’approche globale du traitement et de la prévention de la goutte.
Les traitements utilisés pour la prévention, comme l’allopurinol (voir ci-dessous), peuvent en fait aggraver la situation s’ils sont administrés pendant une crise, et doivent donc être retenus jusqu’à la résolution de la crise pendant plusieurs semaines.
Il existe un certain nombre de mesures qui peuvent aider à résoudre une crise de goutte. Voir le tableau 2 pour un résumé des stratégies de traitement de la goutte aiguë. Un principe est que le traitement d’une crise de goutte doit être instauré rapidement, car un traitement rapide peut souvent être récompensé par une amélioration rapide.
Si on laisse une crise de goutte durer plus d’un jour ou deux avant de commencer le traitement, la réponse au traitement peut être beaucoup plus lente.
Tableau 2 : Médicaments pour traiter les crises aiguës de goutte
- Anti-inflammatoires non stéroïdiens (AINS) ou inhibiteurs de la COX-2
Exemples d’AINS : Naproxène 500mg deux fois par jour, indométhacine 25mg trois fois par jour. Exemple d’inhibiteur de la COX-2 : célécoxib 200 mg deux fois par jour. Effets secondaires possibles : Élévation de la pression artérielle, gonflement des chevilles, maux d’estomac, ulcère (l’utilisation à long terme peut présenter un risque accru de crise cardiaque ou d’accident vasculaire cérébral, mais l’utilisation pour la goutte est généralement de très courte durée). A utiliser avec prudence en cas de problèmes rénaux ou hépatiques.- Corticostéroïdes anti-inflammatoires
Exemples de corticostéroïdes anti-inflammatoires : Prednisone 40mg le premier jour, 30mg le 2e jour, 20mg le 3e jour, 10mg le 4e jour. Effets secondaires possibles : Elévation de la pression sanguine, élévation du taux de sucre dans le sang, changements d’humeur. L’utilisation à court terme, comme dans la goutte, est généralement beaucoup mieux tolérée que l’utilisation à long terme. A utiliser avec prudence en cas de diabète.- Colchicine
Dans le passé, de fortes doses de colchicine étaient utilisées pour les crises de goutte, mais cela avait tendance à provoquer des diarrhées chez un grand nombre de patients. Il a été démontré que des doses plus faibles de colchicine sont aussi efficaces que des doses élevées pour une crise de goutte, et beaucoup mieux tolérées. En supposant qu’il n’y ait pas d’autres problèmes médicaux nécessitant un ajustement de la dose, pour une crise de goutte, un patient recevrait deux comprimés de colchicine, 0,6 mg chacun, dès que possible après le début de la crise. Il recevra ensuite un comprimé supplémentaire une heure plus tard. La dose de colchicine doit être ajustée chez les patients dont la fonction rénale est considérablement réduite. La colchicine a des interactions avec certains autres médicaments, plus particulièrement la clarithromycine (Biaxin®).- Injections locales de stéroïdes
Exemple d’injections de stéroïdes : différentes doses utilisées en fonction de la taille de l’articulation concernée, et plusieurs préparations disponibles. Effets secondaires possibles : Dans 1 à 2 % des cas, une réaction locale à l’injection peut survenir, et l’articulation peut s’aggraver temporairement le lendemain, nécessitant l’application de glace. Chez les diabétiques, une seule injection locale peut augmenter temporairement la glycémie.
a) Mesures physiques dans le traitement d’une crise aiguë de goutte : Il est important de se lever du pied si la crise de goutte se situe dans le membre inférieur. Essayer d’ignorer la crise peut conduire à une durée plus prolongée. La glace locale s’est avérée utile (pas plus de 10 minutes à la fois, pour éviter d’endommager la peau). L’élévation des jambes est utile pour certains.
b) Médicaments pour la goutte aiguë :
- Les anti-inflammatoires non stéroïdiens et les inhibiteurs de la COX-2 constituent le pilier du traitement des crises aiguës de goutte chez les patients qui n’ont pas de contre-indication à leur égard. Ces médicaments comprennent des agents tels que le naproxène (Naprosyn®), l’ibuprofène (Motrin®), le célécoxib (Celebrex®), l’indométhacine (Indocin®) et bien d’autres. Ces agents diminuent de manière fiable l’inflammation et la douleur de la goutte. Cependant, les patients souffrant d’ulcères, d’hypertension, de maladies coronariennes et de rétention d’eau doivent être prudents avec ces agents, même pour les traitements de courte durée (généralement 3 à 7 jours) nécessaires pour résoudre une crise de goutte. Les doses d’anti-inflammatoires non stéroïdiens nécessaires pour résoudre une crise de goutte sont plus élevées, car un effet anti-inflammatoire complet est nécessaire. Voir les exemples de dosage dans le tableau 2. Les niveaux de dosage en vente libre, par exemple l’ibuprofène à 200mg, deux comprimés trois fois par jour, sont souvent insuffisants.
- Les corticostéroïdes, tels que la prednisone et la méthylprednisolone (Medrol®), sont des agents anti-inflammatoires assez efficaces contre les crises de goutte. Les stéroïdes anti-inflammatoires ont une action et des effets secondaires très différents de ceux des stéroïdes à hormones mâles. Les stéroïdes anti-inflammatoires présentent des risques à long terme, tels que l’amincissement des os et les infections, mais leur risque pour un traitement à court terme (par exemple, 3 à 7 jours) est relativement faible. Ces agents peuvent augmenter la pression artérielle et la glycémie, et peuvent donc constituer un problème pour les personnes souffrant d’hypertension non contrôlée ou de diabète sucré non contrôlé.
- La colchicine (Colcrys®) a un rôle à la fois dans la prévention et le traitement des crises de goutte (voir ci-dessous pour une discussion sur son rôle dans la prévention). Voir les détails sur la colchicine pour les crises de goutte dans le tableau 2. Une caractéristique intéressante de la colchicine est sa spécificité. Par exemple, elle peut résoudre une crise de goutte, mais elle n’aide pas une poussée de polyarthrite rhumatoïde. Si le niveau de colchicine s’accumule trop, comme cela pourrait être le cas si une dose habituelle était administrée à un patient souffrant d’une grave maladie rénale, une toxicité peut se produire, telle que la suppression de la production de cellules sanguines. Dans le passé, la colchicine était également utilisée par voie intraveineuse en plus de son utilisation orale. L’utilisation intraveineuse peut être très efficace et ne provoque pas de diarrhée par cette voie, mais cet agent doit être administré avec une extrême prudence, car une erreur de dosage peut arrêter la production de cellules sanguines par la moelle osseuse et être potentiellement mortelle. Pour cette raison, la colchicine intraveineuse est très rarement utilisée aujourd’hui. Les patients demandent souvent pourquoi la colchicine, qui était disponible sous une forme sans marque depuis de nombreuses années, est maintenant un médicament de marque (Colcrys®). C’est le résultat des efforts de la FDA pour examiner et normaliser la production de médicaments qui existent depuis longtemps et qui n’ont pas été examinés auparavant par la FDA. La colchicine est l’un des rares médicaments pour lesquels de nouvelles études ont été réalisées (par exemple, sur les interactions médicamenteuses et la réévaluation de la posologie) et pour lesquels la FDA a accordé le statut de marque à un fabricant, bien que la forme sans marque soit disponible depuis longtemps.
- L’injection locale de préparations cristallines de corticostéroïdes peut être une excellente option si une personne a une crise de goutte à une seule articulation. Les préparations injectées comprennent l’acétate de méthylprednisolone (Depo-Medrol®), la triamcinolone (Aristospan®) et la bétaméthasone (Celestone®). Parmi ces préparations, la bétaméthasone est celle qui dure le moins longtemps dans l’articulation, mais la goutte a tendance à se résorber d’elle-même en quelques semaines, dans tous les cas, de sorte que cette option peut être tout à fait efficace. L’avantage de la bétaméthasone est une diminution de la probabilité de poussées temporairement aggravées le lendemain de l’injection, qui est l’effet indésirable le plus courant des injections locales de stéroïdes. L’injection locale comporte également un très faible risque d’introduction d’une infection dans l’articulation, mais présente l’avantage, si le diagnostic de goutte n’est pas encore définitif, de pouvoir prélever un échantillon de liquide par la même aiguille et de l’analyser pour détecter la présence de cristaux d’acide urique.
(Retour en haut de l’article)
Comment prévenir une crise de goutte ?
Le rôle de l’alimentation dans la prévention de la goutte : Les aliments pouvant directement déclencher des crises de goutte, il est clair que les patients goutteux doivent recevoir des conseils sur ceux qui sont les plus susceptibles d’induire des crises. Le contrôle diététique peut être suffisant chez un patient dont le taux d’acide urique est légèrement élevé, par exemple 7,0 mg/dL (en notant que tout taux d’acide urique supérieur à 6,0 est considéré comme élevé pour un patient atteint de goutte, même s’il se situe dans ce que le laboratoire appelle la « fourchette normale ».)
Pour ceux dont le taux est plus élevé, par exemple 10.0 mg/dL, le régime alimentaire seul ne permet généralement pas de prévenir la goutte. Pour ces derniers, même un régime très strict ne réduit l’acide urique sanguin que d’environ 1 mg/dL – ce qui n’est pas suffisant, en général, pour empêcher l’acide urique de précipiter dans les articulations. Le seuil à partir duquel les patients atteints de goutte semblent réduire considérablement leur nombre de crises est celui où leur taux d’acide urique est ramené en dessous de 6,0 mg/dL.4
Avec les réserves ci-dessus, il est utile de prêter attention au régime alimentaire chez les patients atteints de goutte, et plus particulièrement lors de la mise en place initiale d’un médicament destiné à réduire l’acide urique (qui peut, paradoxalement, déclencher initialement des crises de goutte). Il existe quelques principes de base du régime alimentaire dans le cas de la goutte qui ont résisté à diverses études : limiter la viande rouge et les sauces à base de viande, limiter les crustacés et limiter l’alcool, en particulier la bière.5,6 La viande rouge et les crustacés (par exemple, les coquilles Saint-Jacques, les crevettes et les moules) devraient, dans l’idéal, être consommés moins fréquemment et en plus petites portions (par exemple, 3 oz). Tous les types d’alcool entraînent une plus grande réabsorption de l’acide urique par les reins, ce qui augmente le taux d’acide urique dans le sang, mais la bière a sa propre teneur élevée en purine et contribue donc à l’élévation du taux d’acide urique dans le sang de deux manières différentes. Les protéines végétales sont décomposées en purine, mais ne semblent pas être un facteur contribuant de manière significative à la goutte. Les produits laitiers à faible teneur en matières grasses, bien que les protéines légères soient décomposées en purine, ne semblent pas non plus contribuer au risque de goutte (et pourraient même avoir un effet protecteur).5 Certains glucides, tels que les flocons d’avoine, le germe de blé et le son, ont une teneur modérée en purine, mais il n’a pas été démontré qu’ils constituaient des facteurs de risque de goutte importants. Pour les personnes intéressées par l’abaissement maximal de l’acide urique par voie alimentaire, deux « Gout Haters Cookbooks » figurent dans la section « Livres sur la goutte » ci-dessous. et leurs quatre livres de cuisine peuvent être achetés en ligne.
b) Le rôle de l’activité physique dans la prévention de la goutte : Avec le régime alimentaire, l’activité physique peut aider à la perte de poids, et la goutte a été associée au surpoids.7 chez les patients atteints de goutte bien établie, en particulier si les radiographies ont démontré des dommages articulaires dans le pied, un programme d’exercice à faible impact est raisonnable. Un programme d’exercice combiné à un régime alimentaire dans le cas de la goutte peut réduire le risque de crises.7 Si une crise semble se manifester dans l’extrémité inférieure, il est conseillé aux patients d’essayer de se lever de leurs pieds, car les chocs semblent aggraver les crises de goutte. Les indices de la survenue d’une crise de goutte sont un gonflement local, une chaleur, une rougeur et une sensibilité dans une articulation, en particulier au niveau du pied, de la cheville ou du genou. Certains patients ont de la fièvre et des frissons comme premier avertissement de l’arrivée d’une crise de goutte.
c) Le rôle des médicaments dans la prévention de la goutte : (voir le tableau 3 pour un résumé des médicaments permettant de prévenir les crises de goutte.)
Tableau 3 : Médicaments pour prévenir les crises de goutte
- Allopurinol et fébuxostat : pour diminuer la production d’acide urique
- Probénécide et lesinurad : pour augmenter l’excrétion de l’acide urique
- Pegloticase : pour augmenter la dégradation de l’acide urique
- Colchicine : pour diminuer la capacité des cristaux d’acide urique à provoquer une inflammation.
1. Médicaments standards dans la prévention des crises de goutte :
i. Colchicine (Colcrys®) : en reprenant l’analogie des » allumettes » évoquée plus haut1, l’utilisation de la colchicine peut être considérée comme un » amortisseur » des » allumettes » d’acide urique. La colchicine ne réduit pas les réserves d’acide urique de l’organisme, mais elle diminue l’intensité de la réaction inflammatoire de l’organisme à ces cristaux. Des études récentes ont montré qu’au moins un des mécanismes d’action de la colchicine consiste à agir pour prévenir une cascade de réactions qui conduisent à la production d’interleukine 1-bêta, qui est une protéine inflammatoire (cytokine), importante dans l’inflammation de la goutte.8
Lorsqu’il est utilisé sous forme d’un ou deux comprimés par jour (0,6mg chacun), la plupart des personnes tolèrent bien ce médicament, et cette dose peut aider à prévenir les crises de goutte. Certains médecins commenceraient la colchicine après une crise de goutte très sévère ou deux crises modérément sévères, et au-delà, utiliseraient l’allopurinol. Si un patient a deux crises de goutte au cours d’une même période de 12 mois, il est généralement recommandé de le traiter avec un médicament pour réduire l’acide urique, ce que la colchicine ne fait pas. Voir ci-dessous pour une discussion sur les agents abaissant l’acide urique, l’allopurinol et le probénécide. L’utilisation à long terme de la colchicine a un effet rare sur les nerfs et les muscles, et un test sanguin du muscle (CPK) est contrôlé à des intervalles d’environ six mois chez les patients prenant régulièrement de la colchicine. La colchicine joue également un rôle important lorsque les patients commencent un traitement à l’allopurinol (voir ci-dessous) afin de prévenir l’augmentation des crises de goutte qui peut se produire lorsque l’on commence à prendre de l’allopurinol. La colchicine, dans ce cas, est souvent retirée au bout de six mois environ, en supposant qu’aucune crise de goutte ne soit survenue.
ii. Allopurinol : Cet agent est actuellement le médicament le plus utilisé pour la prévention de la goutte. L’allopurinol bloque l’enzyme xanthine oxydase, qui bloque la dégradation des purines, diminuant ainsi la quantité totale d’acide urique dans l’organisme. L’allopurinol est efficace pour prévenir la goutte, quel que soit le mécanisme de l’augmentation de l’acide urique. Qu’une personne fabrique trop d’acide urique ou qu’elle ait des difficultés à l’excréter par le rein, la diminution de la production d’acide urique par l’allopurinol conduit au même objectif : une diminution de l’acide urique total de l’organisme.
Dans la semaine qui suit la prise d’une dose, l’acide urique est significativement abaissé par l’allopurinol. L’effet indésirable le plus fréquent de l’allopurinol est une augmentation des crises de goutte au début du traitement. C’est la raison pour laquelle il est souvent commencé en même temps que la colchicine (voir ci-dessus), de sorte que pendant que les « allumettes « 1 sont lentement éliminées, celles qui restent sont « amorties ». Les autres effets indésirables de l’allopurinol comprennent des éruptions cutanées, une anomalie des tests sanguins hépatiques et, occasionnellement, une baisse du nombre de globules blancs. L’ampicilline, un antibiotique, semble provoquer davantage d’éruptions cutanées chez les patients qui prennent déjà de l’allopurinol. Un effet secondaire rare mais très grave est le syndrome d’hypersensibilité à l’allopurinol, qui peut se manifester par une éruption cutanée sévère accompagnée d’une anomalie grave du foie et des cellules sanguines. Ce syndrome serait plus probable si le patient présente une fonction rénale anormale.9 Bien que ce point fasse l’objet d’un débat important10, il est généralement admis que les patients présentant une fonction rénale anormale doivent commencer le traitement par l’allopurinol à faible dose et augmenter la dose, afin de s’assurer que l’allopurinol est effectivement excrété. Le taux d’acide urique chez ces patients est suivi de près et il est utilisé comme guide lorsque la dose d’allopurinol est augmentée lentement. La gravité du syndrome d’hypersensibilité à l’allopurinol rappelle que des critères spécifiques doivent être utilisés pour décider quels patients doivent être traités par l’allopurinol (voir le tableau 4 : raisons d’utiliser un médicament pour abaisser l’acide urique).
Tableau 4 : Raisons d’utiliser des médicaments pour abaisser l’acide urique
- Goutte avec plus de deux crises par an, que ce soit en raison d’une surproduction d’acide urique ou d’une difficulté à l’excréter
- Collections chroniques visibles d’acide urique (tophi)
- Acide urique élevé dans l’urine (plus de 800 mg par 24 heures), surtout si antécédents de calculs rénaux
- Échec des autres options pour contrôler l’arthrite de la goutte (par exemple, échec du probénécide)
- Lorsqu’une personne reçoit une chimiothérapie pour une leucémie ou un lymphome et que l’on s’attend à ce que de nombreuses cellules tumorales soient tuées (puisque l’un des produits de dégradation des cellules est la purine qui se décompose en acide urique)
iii. Febuxostat (Uloric®) : ce médicament a été approuvé par la FDA en février 2009 pour traiter les patients atteints de goutte en abaissant leur taux d’acide urique. Il fonctionne de manière similaire à l’allopurinol en ce sens qu’il inhibe la xanthine oxydase, une enzyme clé dans la voie qui produit l’acide urique, et réduit ainsi le taux total d’acide urique dans le corps.
Comme l’allopurinol, l’effet secondaire le plus courant du fébuxostat est de provoquer une poussée de goutte après l’instauration de ce médicament. Comme pour l’allopurinol, il est raisonnable, dans la mesure du possible, d’ajouter un médicament préventif, tel que la colchicine, pendant au moins les six premiers mois suivant le début du traitement par le fébuxostat, afin d’éviter les poussées de goutte. Plus tard, au fur et à mesure que l’acide urique total du corps diminue, cela ne sera généralement plus nécessaire.
Un avantage potentiel du fébuxostat est qu’il est structurellement assez différent de l’allopurinol, et peut donc probablement être utilisé chez les patients allergiques à l’allopurinol. Seul un nombre limité de patients allergiques à l’allopurinol a été étudié à ce jour, mais le médicament a été toléré chez ces patients. Un autre avantage est que son excrétion est davantage gérée par le foie que par le rein, contrairement à l’allopurinol, et le fébuxostat peut donc présenter un certain avantage chez les patients présentant un dysfonctionnement rénal.
Contrairement à l’allopurinol, qui interagit avec la warfarine (Coumadin®), le fébuxostat n’a pas présenté cette interaction lors des études. Le fébuxostat est approuvé par la FDA pour commencer à 40mg par jour, et si l’acide urique n’a pas atteint l’objectif (moins de 6,0mg/dL) après deux semaines de traitement, la dose peut être augmentée à 80mg par jour. La dose de 80 mg de fébuxostat a permis à un plus grand nombre de patients d’atteindre un taux d’acide urique inférieur à 6 mg/dL que la dose de 300 mg d’allopurinol, la dose d’allopurinol la plus couramment utilisée. Les rhumatologues ajustent souvent des doses d’allopurinol supérieures à 300mg lorsque cela est nécessaire pour atteindre l’objectif d’acide urique, bien que la littérature sur les doses plus élevées d’allopurinol soit limitée.
Les patients dont le taux d’acide urique est contrôlé et qui s’en sortent bien avec l’allopurinol n’auraient apparemment aucune raison de passer à ce nouvel agent, compte tenu du coût inférieur de l’allopurinol et de ses 40 ans d’historique de très bonne sécurité globale (voir la discussion » Allopurinol » ci-dessus).
En mars 2018, une étude sur la sécurité cardiaque de l’allopurinol par rapport au febuxostat a été publiée. Cette étude a porté sur 5000 patients, qui avaient tous des antécédents de maladies cardiovasculaires, soit une crise cardiaque, un accident vasculaire cérébral, un mini-accident vasculaire cérébral ou la nécessité d’une chirurgie cardiaque urgente pour une maladie coronaire. L’étude a cherché à déterminer si une combinaison d’issues cardiovasculaires (crise cardiaque, accident vasculaire cérébral, décès d’origine cardiaque, mini-accident vasculaire cérébral, chirurgie cardiaque urgente pour maladie coronarienne) était plus fréquente dans le groupe allopurinol ou le groupe fébuxostat. Pour la combinaison de ces résultats, les deux médicaments étaient identiques. Cependant, le nombre de décès cardiaques était plus élevé dans le groupe fébuxostat. L’interprétation de l’étude a posé quelques problèmes, car presque tous les patients décédés avaient déjà arrêté leur traitement contre la goutte, qu’il s’agisse d’allopurinol ou de febuxostat. Le taux d’abandon était également élevé au cours des cinq années de l’étude. De nombreux rhumatologues ne pensent pas qu’il s’agisse d’une étude définitive et il existe d’autres données qui ne montrent pas d’augmentation du risque cardiaque avec le febuxostat. Cependant, la FDA a interprété cette étude et a mis un avertissement sur le febuxostat indiquant qu’il doit être utilisé en deuxième ligne, après l’allopurinol.
Maintenant que la FDA a mis cet avertissement sur le febuxostat, même chez les personnes présentant une anomalie rénale, nous serions susceptibles de commencer par l’allopurinol. Pour les personnes déjà sous fébuxostat qui n’ont jamais pris d’allopurinol, c’est une décision au cas par cas de passer ou non à l’allopurinol. C’est une décision difficile, car ils tolèrent le fébuxostat et peuvent ne pas tolérer l’allopurinol. L’allopurinol présente un risque plus élevé de réaction cutanée grave chez les personnes présentant une anomalie de la fonction rénale, et les personnes présentant cette anomalie sont souvent celles qui prennent du fébuxostat. Après avoir considéré toutes ces données, de nombreux patients dans cette situation ont choisi de rester sous fébuxostat, mais chaque personne, avec son médecin, prend cette décision.
iv. Probénécide : Ce médicament augmente la quantité d’acide urique excrétée dans l’urine, en diminuant la quantité réabsorbée par le rein. Les médicaments qui peuvent faire sortir plus d’acide urique dans l’urine sont appelés agents uricosuriques. Le probénécide est le principal agent de ce type utilisé aux États-Unis. Le probénécide peut réussir à ramener l’acide urique sanguin en dessous de 6,0, et à réduire ou à prévenir les crises de goutte.
Comme l’allopurinol, un nombre accru de crises de goutte peut survenir au début du probénécide, et pour cette raison, la colchicine est souvent administrée pendant les six premiers mois du traitement. Cependant, contrairement à l’allopurinol, le probénécide peut, au début du traitement, augmenter l’acide urique urinaire, ce qui peut entraîner la formation d’un calcul rénal. Pour cette raison, il est raisonnable de vérifier la présence d’acide urique dans un échantillon d’urine de 24 heures avant de commencer le probénécide, et si ce résultat est >800mg/24 heure, ce traitement doit être reconsidéré. Si le résultat est limite, on conseille au minimum au patient de boire davantage de liquides, afin de prévenir les calculs rénaux au début du traitement. Il existe également des médicaments qui peuvent modifier l’acidité de l’urine, et en alcalinisant l’urine dans ce cas, le risque de calculs rénaux peut être diminué (l’acide urique est plus soluble en milieu alcalin, donc moins susceptible de cristalliser). Le probénécide peut également provoquer une éruption cutanée, mais semble moins susceptible que l’allopurinol de provoquer une réaction d’hypersensibilité très grave. Le probénécide n’est pas efficace si le patient présente un dysfonctionnement rénal. Démonstration de l’efficacité du lesinurad, en association avec l’allopurinol, pour amener les patients à leur objectif d’acide urique.
12 Sundy JS et al : Réduction des niveaux d’urate plasmatique après traitement avec des doses multiples de Pegloticase (Uricase conjuguée au polyéthylène glycol) chez les patients atteints de goutte en échec de traitement : Résultats d’une étude randomisée de phase II. Arthritis Rheum 58:9, 2882-2891, 2008.
13 Sundy JS et al : Efficacité et sécurité de la pegloticase intraveineuse (PGL) dans l’échec du traitement de la goutte (TFG) : Résultats de Gout-1 et Gout-2. Résumé de la Ligue européenne contre le rhumatisme THU0446, juin 2009. Résumé de la réunion 2009 de la Ligue européenne contre le rhumatisme
14 Baraf, HSB et al : Réduction de la taille du tophus avec la pegloticase (PGL) dans l’échec du traitement de la goutte (TFG) : Results from Gout-1 and Gout-2, European League Against Rheumatism Abstract OP-0047, juin 2009. Résumé de la réunion 2009 de la Ligue européenne contre le rhumatisme
15 So A et al : Une étude pilote de l’inhibition de l’IL-1 par l’anakinra dans la goutte aiguë. Arthritis Research & Therapy 9(2):R28, 2007. Premières données indiquant que l’anakinra était efficace dans les poussées de goutte.
16 Terkeltaub R et al : The interleukin 1 inhibitor rilonacept in treatment of chronic gouty arthritis : results of a placebo-controlled, monosequence crossover, non-randomised, single-blind pilot study. Annals of Rheumatic Disease 68:1613-1617, 2009
17 So A at al : Canakinumab (ACZ885) Vs. Triamcinolone Acetonide for Treatment of Acute Flares and Prevention of Recurrent Flares in Gouty Arthritis Patients Refractory to or Contraindicated to NSAIDs and/or Colchicine. Résumé LB4 de l’American College of Rheumatology, octobre 2009. Résumé de la réunion de l’American College of Rheumatology, octobre 2009
18 Fitz-patrick D et al : Résumé 150 : Effects of a Purine Nucleoside Phosphorylase Inhibitor, BCX4208, on the Serum Uric Acid Concentrations in Patients with Gout. Abstract from the American College of Rheumatology Meeting November 2010.
(Go back to top of article)
Updated: 12/18/2017
Authors

Attending Physician, Hospital for Special Surgery
Professor of Clinical Medicine, Weill Cornell Medical College