Maladie du Lyme
Aperçu
Le premier cas d’anaplasmose humaine a été décrit en 1990, lorsqu’un patient du Wisconsin a développé une maladie fébrile sévère suite à une morsure de tique et est décédé deux semaines plus tard. Les frottis sanguins ont révélé la présence d’amas de bactéries dans les neutrophiles du patient, semblables aux morulae observées dans les monocytes en cas d’infection par E. chaffeensis. Cependant, les cultures et les tests sérologiques pour E. chaffeensis étaient négatifs. Néanmoins, l’évolution clinique du patient a suggéré une certaine forme d’ehrlichiose, et lorsque plusieurs autres cas de la maladie ont été signalés dans le nord du Midwest au cours des années suivantes, on a supposé qu’une nouvelle espèce d’Ehrlichia pouvait être en train d’apparaître. La nouvelle maladie a été provisoirement baptisée » ehrlichiose granulocytaire humaine « , ou HGE.
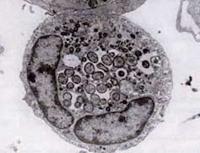
En 1994, des études de séquençage de l’ADN ont révélé que l’agent HGE était clairement distinct d’E. chaffeensis mais essentiellement identique à deux agents pathogènes vétérinaires ehrlichiens connus auparavant, E. equi et E. (Cytoecetes) phagocytophila. Dans le cadre d’un nouveau schéma taxonomique mis en œuvre depuis, ces trois organismes ont été réunis en une seule espèce au sein d’un nouveau genre, Anaplasma. La nouvelle espèce est désignée sous le nom d’Anaplasma phagocytophilum, et la maladie qu’elle provoque est désormais connue sous le nom d’anaplasmose granulocytaire humaine, ou HGA.
Comme les espèces Ehrlichia, les organismes Anaplasma sont petits, gram-négatifs et intracellulaires. A. phagocytophilum cible les neutrophiles, altère leur fonction chez l’hôte et forme des morulae à l’intérieur de vacuoles. La plupart des dommages qu’il cause semblent être liés aux processus inflammatoires de l’hôte, car il existe peu de preuves d’une corrélation entre le nombre d’organismes et la gravité de la maladie de l’hôte.
L’anaplasmose est une infection mondiale, présente en Amérique du Nord, dans la plupart des pays d’Europe et en Asie orientale. Les tiques du complexe Ixodes persulcatus sont les vecteurs : I. scapularis dans les régions du nord-est et du haut Midwest des États-Unis ; I. pacificus dans le nord-ouest du Pacifique ; I. ricinus en Europe ; et I. persulcatus en Asie. A. phagocytophilum se maintient dans la nature par un cycle entre ces tiques et divers petits mammifères, principalement les souris et autres petits rongeurs. Comme les tiques Ixodes sont également les vecteurs de la maladie de Lyme, de la babésiose et de l’encéphalite à tiques, la coinfection d’Anaplasma avec ces autres maladies peut se produire et se produit effectivement chez les humains.
Aux États-Unis, les cas de HGA ont dépassé en nombre ceux de l’Ehrlichiose monocytaire humaine (EMH) Semblable à l’EMH et à l’ehrlichiose ewingii humaine, l’âge médian des patients atteints de HGA est d’environ 50 ans.
Signes et symptômes
L’évolution clinique de la HGA va de l’infection asymptomatique à la maladie mortelle. Les premiers symptômes, qui surviennent environ cinq à dix jours après la piqûre de tique, sont en grande partie non spécifiques : fièvre, frissons, céphalées sévères et myalgies;j nausées, toux et arthralgies peuvent également survenir. Les éruptions cutanées sont peu fréquentes mais ont été signalées.
Par rapport à l’EMH, l’AGH semble moins susceptible d’impliquer le système nerveux central, mais les neuropathies périphériques (par exemple, engourdissement et picotements) sont plus fréquentes et peuvent durer des semaines à des mois. Parmi les résultats neurologiques rapportés dans la littérature médicale figurent la paralysie faciale, la polyneuropathie démyélinisante et la plexopathie brachiale. Un syndrome de détresse respiratoire et un syndrome de type choc septique ou toxique ont été signalés, mais semblent être moins fréquents que dans le cas de l’HME. Le taux de létalité global de l’HGA est très faible (moins de 1 %), la plupart des décès résultant d’infections opportunistes (par exemple, oesophagite à herpès simplex, pneumonie à Candida et aspergillose pulmonaire) chez les patients immunodéprimés.
Diagnostic
Les analyses sanguines standard dans l’AGH révèlent généralement des résultats similaires à ceux observés dans l’EMH : leucopénie, thrombocytopénie et anomalies de la fonction hépatique (transaminases élevées). Cependant, les anomalies hématologiques disparaissent souvent dès la deuxième semaine des symptômes, de sorte que leur absence doit être interprétée dans ce contexte si les patients se présentent plus tard au cours de leur maladie. En général, un traitement antibiotique empirique doit être envisagé pour les patients des zones endémiques qui présentent une maladie fébrile aiguë évoquant une HGA.
Pour un diagnostic spécifique, les frottis sanguins colorés au Wright ou au Giemsa ont un rendement légèrement supérieur à celui de l’HME, mais ne sont toujours pas optimaux pour une utilité clinique générale, étant donné qu’il semble y avoir une grande variation (25-75%) dans la sensibilité de ces tests pour visualiser les morulae dans les neutrophiles de l’hôte. Les tests de réaction en chaîne par polymérase (PCR), dont la sensibilité est estimée à 67-90 %, sont plus utiles, mais pas toujours disponibles. Une antibiothérapie préalable réduit considérablement la sensibilité de ces deux méthodes de diagnostic.
Les tests sérologiques sont utiles pour confirmer le diagnostic d’anaplasmose. La méthode la plus couramment utilisée est l’immunofluorescence indirecte (IFA) des anticorps IgM et IgG anti-A. phagocytophilum. La séroconversion est peut-être la preuve de laboratoire la plus sensible de l’infection par A. phagocytophilum, mais elle n’est pas toujours obtenue de manière suffisamment rapide pour fournir des données utiles aux décisions cliniques (c’est-à-dire au traitement).