Ophtalmopathie de Graves
US Pharm. 2011;36(4):20-28
La glande thyroïde facilite la croissance et la maturation normales. Elle y parvient en maintenant un niveau de métabolisme dans les tissus qui est optimal pour une fonction normale.1 L’hyperthyroïdie désigne un état de disponibilité excessive des hormones thyroïdiennes dans les tissus périphériques et se caractérise par un hypermétabolisme et des taux sériques élevés d’hormones thyroïdiennes libres.2,3 On estime que 10 % à 17 % de tous les patients hyperthyroïdiens sont âgés de plus de 60 ans2. Chez les patients âgés atteints d’hyperthyroïdie et de fibrillation auriculaire, il existe un risque d’embolie systémique et d’accident vasculaire cérébral, en particulier chez ceux qui présentent une comorbidité cardiaque.2 La présentation clinique de l’hyperthyroïdie peut être dramatique ou subtile, avec de nombreux symptômes et signes communs similaires à ceux d’un excès adrénergique, tels que la nervosité, les palpitations, l’augmentation de la transpiration, l’hypersensibilité à la chaleur, la perte de poids, la fatigue, l’augmentation des selles et les tremblements.3 Le diagnostic de cette pathologie est établi cliniquement et par des tests de la fonction thyroïdienne. Le traitement est basé sur la cause du trouble.
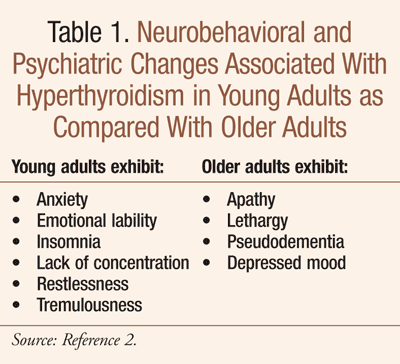
Chez les personnes âgées, cependant, l’apparition de l’hyperthyroïdie peut se présenter de manière atypique. Appelés hyperthyroïdie apathique ou masquée, les symptômes ressemblent à ceux de la dépression ou de la démence (TABLEAU 1).2,3 C’est notamment le cas du goitre nodulaire toxique ; le goitre multinodulaire toxique est plus fréquent dans la population gériatrique et a été signalé chez environ 50 % des patients âgés atteints d’hyperthyroïdie2,3. Les personnes âgées sont plus susceptibles de présenter une fibrillation auriculaire, une syncope, une altération du sensorium, une insuffisance cardiaque et une faiblesse.3,4 Certains patients âgés atteints d’hyperthyroïdie apathique présentent une perte de poids, une anorexie, des nausées, des vomissements et une constipation, au lieu des signes et symptômes gastro-intestinaux classiques de l’hyperthyroïdie, tels qu’une perte de poids avec augmentation de l’appétit et un transit intestinal rapide (c’est-à-dire une défécation fréquente).2 défécation fréquente).2 Dans une étude, la perte de poids a été notée comme un résultat diagnostique majeur chez 80 % des patients âgés de plus de 70 ans ; les experts indiquent que l’hyperthyroïdie doit être écartée comme cause de perte de poids chez les personnes âgées avant de procéder à des évaluations larges pour une maladie gastro-intestinale ou une malignité occulte2.
La plupart des patients âgés ne présentent pas de tremblement ou d’exophtalmie, une protrusion anormale de l’œil.3 Les signes oculaires observés chez les personnes âgées sont en grande partie dus à une stimulation adrénergique excessive et comprennent le regard fixe, le décalage des paupières, la rétraction des paupières et une légère injection conjonctivale. Les symptômes et les signes d’hyperthyroïdie chez les personnes âgées peuvent ne concerner qu’un seul système organique et disparaissent généralement avec un traitement réussi.3
Maladie de Graves
La maladie de Graves (goitre diffus toxique), nommée d’après Robert J. Graves, MD, est la cause la plus fréquente d’hyperthyroïdie.3,5,6 Chez les personnes âgées, la maladie de Graves est une cause fréquente d’hyperthyroïdie, mais d’autres étiologies sont plus fréquentes2. Elle est classée comme un trouble thyroïdien auto-immun dans lequel les immunoglobulines stimulant la thyroïde se lient aux récepteurs de la thyrotropine et les activent ; la glande thyroïde se développe en conséquence, ce qui amène les follicules thyroïdiens à synthétiser davantage d’hormones thyroïdiennes6,7. La maladie de Graves se caractérise par une hyperthyroïdie (due à la circulation d’auto-anticorps) et un ou plusieurs des symptômes suivants : goitre, exophtalmie et dermopathie infiltrante (également appelée myxœdème prétibial) (TABLEAU 2).3,6 On pense que cette affection peut représenter un élément de processus auto-immuns plus étendus qui entraînent le dysfonctionnement de plusieurs organes chez certains patients.6 La maladie de Basedow est associée à d’autres affections, notamment l’anémie pernicieuse, le vitiligo, le diabète sucré de type 1, l’insuffisance surrénale auto-immune, la sclérose systémique, la myasthénie grave, le syndrome de Sjögren, la polyarthrite rhumatoïde et le lupus érythémateux systémique8.

Les femmes sont sept fois plus susceptibles de développer la maladie de Basedow que les hommes et le développement de la maladie se produit généralement après l’âge de 20 ans ; les autres facteurs de risque comprennent le stress, la grossesse et le tabagisme9.
Ophtalmopathie infiltrante
L’ophtalmopathie infiltrante est une caractéristique de la maladie de Basedow et un développement grave qui est responsable de l’exophtalmie observée dans cette affection.3,6 Les manifestations oculaires peuvent survenir des années avant, au moment ou après la découverte de l’hyperthyroïdie et sont appelées ophtalmopathie de Basedow. Environ 25 % à 30 % des patients atteints de la maladie de Graves présentent des signes cliniques d’ophtalmopathie de Graves.6
Bien que la cause de cette ophtalmopathie soit inconnue, son mécanisme proposé est le développement d’une inflammation auto-immune rétrobulbaire secondaire à la libération de cytokines, à l’épaississement des muscles extraoculaires et au gonflement du contenu orbitaire.2 Cette affection comporte deux phases : La phase inflammatoire, marquée par un œdème et un dépôt de glycosaminoglycane dans les muscles extra-oculaires, et la phase fibrotique, qui est une phase de convalescence6. De manière caractéristique, les patients présentent une irritation, un larmoiement, une douleur orbitaire, une photophobie, une augmentation du tissu rétro-orbitaire et une exophtalmie ; l’infiltration lymphocytaire des muscles extraoculaires entraîne une faiblesse des muscles oculaires conduisant souvent à une diplopie (vision double).3 L’ophtalmopathie de Basedow s’améliore spontanément chez 64 % des patients6.
Un examen ophtalmologique complet est indiqué si un patient est symptomatique ; il comprend un examen de la rétine et un examen à la lampe à fente réalisés par un ophtalmologiste.6 Afin de suivre cliniquement l’évolution de l’ophtalmopathie, il est nécessaire de mesurer les champs de diplopie, les fissures des paupières, l’amplitude des muscles extraoculaires, l’acuité visuelle et le proptosis (renflement) pour une évaluation quantitative6. La consultation d’un ophtalmologiste peut s’avérer nécessaire en cas de proptose unilatérale ou bilatérale, pour rechercher d’autres étiologies que la maladie de Basedow et pour le suivi de l’acuité visuelle, la prévention de la maladie cornéenne et la fonction des muscles oculaires6. L’évolution de cette maladie est celle d’une progression graduelle sur plusieurs années chez environ 10 à 20 % des patients, suivie d’une stabilité clinique ; une aggravation progressive, avec une déficience visuelle chez certains, est observée chez environ 2 à 5 % des patients.6
Traitement
Il est recommandé que l’ophtalmopathie de Basedow soit traitée en collaboration par un endocrinologue et un ophtalmologue. Le traitement peut nécessiter des corticostéroïdes, une irradiation orbitale et une chirurgie.3 Bien que la correction de l’hyperthyroïdie soit importante pour l’ophtalmopathie, les pharmaciens doivent noter que les médicaments antithyroïdiens (ex, méthimazole, propylthiouracile ) et la thyroïdectomie n’influencent pas l’évolution de l’ophtalmopathie ; le traitement par radio-iode peut exacerber une ophtalmopathie préexistante, mais cela peut être prévenu par un traitement par glucocorticoïdes.6
Ablation de la thyroïde : À long terme, l’ablation de la thyroïde (c’est-à-dire avec de l’iode radioactif I131) peut être bénéfique pour l’ophtalmopathie en raison de la diminution des antigènes partagés par la thyroïde et de l’orbite des réactions auto-immunes ; elle est considérée comme l’agent de choix pour la maladie de Basedow6,10. En général, une amélioration de l’ophtalmopathie est observée avec le traitement de l’hyperthyroïdie ; cependant, l’hypothyroïdie doit être évitée car elle aggrave l’ophtalmopathie.6
Mesures thérapeutiques locales : Les lunettes de soleil, les cache-œil, les larmes et pommades artificielles, le taping nocturne des yeux, les prismes et l’élévation de la tête la nuit ont la capacité de contrôler les symptômes et les signes dans l’ophtalmopathie légère à modérée.6
Les glucocorticoïdes : Comme l’indiquent les données actuelles, les glucocorticoïdes constituent la seule classe de traitement médicamenteux qui, seul ou associé à d’autres thérapies, a un rôle sans équivoque dans la prise en charge de l’ophtalmopathie de Basedow3. Il a été démontré que les glucocorticoïdes diminuent la conversion de la T4 en T3 et réduisent les taux d’hormones thyroïdiennes ; cependant, le profil d’effets indésirables d’une glucocorticothérapie à long terme la rend peu intéressante pour la prise en charge à long terme de l’hyperthyroïdie de Basedow.6 Bien que la prednisone soit habituellement utilisée dans la prise en charge de l’ophtalmopathie de Basedow, d’autres glucocorticoïdes à des doses équivalentes peuvent également être efficaces.6 Le traitement de la maladie active nécessite : 1) des glucocorticoïdes à forte dose11 ; 2) une radiothérapie orbitale ; 3) les deux ; ou 4) une décompression orbitale.6 Dans les cas graves ou progressifs, on peut introduire des glucocorticoïdes à la dose habituelle de 40 mg/jour et les poursuivre jusqu’à l’obtention de signes observables d’amélioration et de stabilité de la maladie ; une diminution de la dose est alors amorcée et poursuivie pendant 4 à 12 semaines.6 De bons résultats ont également été rapportés avec une glucocorticothérapie pulsée à forte dose.6
Radiothérapie orbitale : Avec ou sans glucocorticoïdes, la radiothérapie orbitale peut être essayée en l’absence de réponse au traitement dans la phase inflammatoire ; cela n’augmente pas le risque de tumeurs radio-induites, de cataractes et de rétinopathie (sauf chez les patients diabétiques présentant une rétinopathie possible ou certaine).6 Bien que le succès de la chirurgie par couteau gamma ait été obtenu chez un nombre limité de patients, des études supplémentaires sont nécessaires pour valider cette modalité.6
Traitements divers et nouveaux : L’utilité du traitement diurétique pour l’œdème secondaire à l’engorgement veineux de l’orbite est limitée.6 L’évaluation de nouveaux traitements comprend les analogues de la somatostatine ou les immunoglobulines intraveineuses. Les études sur l’octréotide LAR (à action prolongée et répétable) indiquent des avantages thérapeutiques contradictoires ou marginaux6,12,-14 ; on a signalé que l’infliximab avait permis de traiter avec succès un cas d’ophtalmopathie de Graves menaçant la vue6,15 ; le rituximab peut épuiser transitoirement les lymphocytes B et potentiellement supprimer la phase inflammatoire active de l’ophtalmopathie de Graves6,16. Une étude pilote prospective multicentrique menée chez des patients atteints d’ophtalmopathie de Graves d’apparition récente suggère que l’injection périoculaire de triamcinolone peut réduire la diplopie et la taille des muscles extraoculaires6. Les symptômes et le proptosis dans la phase inactive de l’ophtalmopathie de Basedow se sont améliorés avec la pentoxifylline, selon un essai prospectif et randomisé.6
Chirurgie pour l’ophtalmopathie
Généralement, la chirurgie est réalisée dans la phase fibrotique, lorsque le patient est euthyroïdien6. Elle est considérée comme une option thérapeutique alternative sûre chez les patients qui présentent une ophtalmopathie modérée à sévère, qui ne respectent pas (ou ne tolèrent pas) les médicaments antithyroïdiens, ou qui refusent ou ne peuvent pas subir un traitement par radio-iode.6 La thyroïdectomie (c’est-à-dire quasi-totale) n’a que peu ou pas d’effet sur l’évolution de l’ophtalmopathie.6 Il est souvent nécessaire d’effectuer une chirurgie des muscles extra-oculaires ou des paupières (c’est-à-dire , rééducative) ; une chirurgie des paupières peut être effectuée pour améliorer la kératite d’exposition.6
Hyperthyroïdie subclinique
L’hyperthyroïdie subclinique, caractérisée par une faible quantité de thyréostimuline (TSH) sérique chez des patients dont les sérums de T4 et T3 libres sont normaux et dont les symptômes d’hyperthyroïdie sont absents ou minimes, est beaucoup moins fréquente que l’hypothyroïdie subclinique. Les personnes dont la TSH sérique <0,1 mU/L présentent 1) une incidence accrue de fibrillation auriculaire, en particulier chez les personnes âgées ; 2) une réduction de la densité minérale osseuse ; 3) une augmentation des fractures ; et 4) une mortalité accrue3. Les pharmaciens doivent noter que de nombreux patients atteints d’hyperthyroïdie subclinique prennent de la L-thyroxine ; une réduction de la posologie est la prise en charge la plus appropriée, sauf si l’objectif du traitement est de cibler un cancer ou des nodules thyroïdiens.3 Le traitement est indiqué pour les patients atteints d’hyperthyroïdie subclinique endogène (TSH sérique <0,1 mU/L), notamment en cas de signes de fibrillation auriculaire ou de réduction de la densité minérale osseuse. L’iode radioactif I131 est le traitement habituel.3 Chez les patients présentant des symptômes plus légers, tels que la nervosité, un essai de traitement médicamenteux antithyroïdien (par exemple, le méthimazole ; il est préféré au PTU car il peut être administré une fois par jour et présente un meilleur profil d’effets secondaires) est considéré comme utile.3
Conclusion
Les patients âgés se présentent souvent sans signes et symptômes classiques d’hyperthyroïdie. Les pharmaciens doivent être conscients de l’hyperthyroïdie apathique chez les personnes âgées et de sa comparaison avec l’hyperthyroïdie chez les adultes plus jeunes. L’ophtalmopathie infiltrante, provoquant une exophtalmie – une caractéristique de la maladie de Basedow – doit être reconnue et traitée comme une évolution grave de la maladie.
1. Finkel R, Clark MA, Cubeddu LX, et al, eds. Lippincott’s Illustrated Reviews : Pharmacology. 4th ed. Philadelphie, PA : Lippincott Williams & Wilkins ; 2009:275-284.
2. Hershman JM, Hassani S, Samuels MH. Les maladies thyroïdiennes. In : Halter JB, Ouslander JG, Tinetti ME, et al, eds. Hazzard’s Geriatric Medicine and Gerontology. 6th ed. New York, NY : McGraw-Hill ; 2009:1287-1303.
3. l’hyperthyroïdie. Section : Troubles endocriniens. Sujet : Troubles de la thyroïde. Merck Manuals.com. Révisé en juin 2008.www.merckmanuals.com/professional/sec12/ch152/ch152e.html. Consulté le 18 mars 2011.
4. Monaghan MS, Kissinger JF, Archer J. Troubles endocriniens : affections de la thyroïde et des surrénales. In : Youngkin EQ, Sawin KJ, Kissinger JF, et al. Pharmacotherapeutics : A Primary Care Guide. Upper Saddle River, NJ : Pearson Prentice Hall ; 2005:649-667.
5. Ellis H. Robert Graves : 1796-1852. Br J Hosp Med (Lond). 2006;67(6):313.
6. Yeung SJ, Habra MA, Chiu AC. Graves’s disease. eMedicine from WebMD. Medscape.com. Mis à jour : 26 avril 2010.http://emedicine.medscape.com/article/120619-print. Consulté le 18 mars 2011.
7. Dorland’s Pocket Medical Dictionary. 28e éd. New York, NY : Elsevier Saunders ; 2009.
8. Cruz AA, Akaishi PM, Vargas MA, de Paula SA. Association entre le dysfonctionnement auto-immun de la thyroïde et les maladies auto-immunes non-thyroïdiennes. Ophthal Plast Reconstr Surg. 2007;23(2):104-108.
9. La maladie de Grave.www.MayoClinic.com. 7 juillet 2009.www.mayoclinic.com/health/graves-disease/DS00181. Consulté le 18 mars 2011.
10. Sherman SI, Talbert RL. Thyroid disorders. Dans : DiPiro JT, Talbert RL, Yee GC, et al, eds. Pharmacotherapy : A Pathophysiologic Approach. 7th ed. New York, NY : McGraw-Hill Inc ; 2008:1243-1263.
11. Macchia PE, Bagattini M, Lupoli G, et al. Corticothérapie intraveineuse à haute dose pour l’ophtalmopathie de Graves. J Endocrinol Invest. 2001;24:152-158.
12. Dickinson AJ, Vaidya B, Miller M, et al. Double-blind, placebo-controlled trial of octreotide long-acting repeatable (LAR) in thyroid-associated ophthalmopathy. J Clin Endocrinol Metab. 2004;89(12):5910-5915.
13. Wemeau JL, Caron P, Beckers A, et al. Traitement à l’octréotide (formulation à libération prolongée) chez les patients atteints d’orbitopathie de Graves : résultats cliniques d’une étude de quatre mois, randomisée, contrôlée par placebo et en double aveugle. J Clin Endocrinol Metab. 2005;90:841-848.
14. Stan MN, Garrity JA, Bradley EA, et al. Essai randomisé, en double aveugle, contrôlé par placebo, de l’octréotide à libération prolongée pour le traitement de l’ophtalmopathie de Basedow. J Clin Endocrinol Metab. 2006;91(12):4817-4824.
15. Durrani OM, Reuser TQ, Murray PI. Infliximab : un nouveau traitement pour l’ophtalmopathie associée à la thyroïde menaçant la vue. Orbit. 2005;24(2):117-119.
16. Salvi M, Vannucchi G, Campi I, et al. Treatment of Graves’ disease and associated ophthalmopathy with the anti-CD20 monoclonal antibody rituximab : an open study. Eur J Endocrinol. 2007;156(1):33-40.