Premières idées sur la matière : De Démocrite à Dalton
Théorie atomique moderne

Priestley, Lavoisier et d’autres avaient jeté les bases du domaine de la chimie. Leurs expériences ont montré que certaines substances pouvaient se combiner avec d’autres pour former de nouveaux matériaux, que d’autres substances pouvaient être décomposées pour en former de plus simples, et que quelques « éléments » clés ne pouvaient pas être décomposés davantage. Mais qu’est-ce qui pouvait expliquer cet ensemble complexe d’observations ? John Dalton, un professeur et scientifique britannique exceptionnel, a rassemblé les pièces du puzzle et élaboré la première théorie atomique moderne en 1803. Pour en savoir plus sur les expériences de Priestley et de Lavoisier et sur la façon dont elles ont constitué la base des théories de Dalton, essayez l’expérience interactive Dalton’s Playhouse, dont le lien figure ci-dessous.
Dalton avait pour habitude de suivre et d’enregistrer le temps qu’il faisait dans sa ville natale de Manchester, en Angleterre. Grâce à ses observations du brouillard matinal et d’autres phénomènes météorologiques, Dalton a réalisé que l’eau pouvait exister en tant que gaz qui se mélangeait à l’air et occupait le même espace que l’air. Les solides ne pouvaient pas occuper le même espace que les autres ; par exemple, la glace ne pouvait pas se mélanger à l’air. Qu’est-ce qui pouvait donc permettre à l’eau de se comporter tantôt comme un solide, tantôt comme un gaz ? Dalton a compris que toute matière devait être composée de minuscules particules. À l’état gazeux, ces particules flottent librement et peuvent se mélanger à d’autres gaz, comme l’avait proposé Bernoulli. Mais Dalton a étendu cette idée pour qu’elle s’applique à toute la matière – gaz, solides et liquides. Dalton a d’abord proposé une partie de sa théorie atomique en 1803, puis a affiné ces concepts dans son article classique de 1808 intitulé Un nouveau système de philosophie chimique (auquel vous pouvez accéder par un lien sous l’onglet Ressources).
La théorie de Dalton comportait quatre concepts principaux :
-
Toute la matière est composée de particules indivisibles appelées atomes. Bernoulli, Dalton et d’autres se représentaient les atomes comme de minuscules particules ressemblant à des boules de billard dans divers états de mouvement. Bien que ce concept soit utile pour nous aider à comprendre les atomes, il n’est pas correct, comme nous le verrons dans les modules ultérieurs sur la théorie atomique dont le lien figure au bas de ce module.
-
Tous les atomes d’un élément donné sont identiques ; les atomes de différents éléments ont des propriétés différentes. La théorie de Dalton suggérait que chaque atome d’un élément tel que l’oxygène est identique à tous les autres atomes d’oxygène ; de plus, les atomes d’éléments différents, comme l’oxygène et le mercure, sont différents les uns des autres. Dalton caractérisait les éléments en fonction de leur poids atomique ; cependant, lorsque les isotopes des éléments ont été découverts à la fin des années 1800, ce concept a changé.
-
Les réactions chimiques impliquent la combinaison d’atomes, et non la destruction d’atomes. Les atomes sont indestructibles et inchangeables, donc les composés, comme l’eau et le calx de mercure, sont formés lorsqu’un atome se combine chimiquement avec d’autres atomes. C’était un concept extrêmement avancé pour l’époque ; alors que la théorie de Dalton impliquait que les atomes se liaient entre eux, il faudra attendre plus de 100 ans avant que les scientifiques ne commencent à expliquer le concept de liaison chimique.
-
Lorsque les éléments réagissent pour former des composés, ils réagissent dans des rapports définis, en nombres entiers. Les expériences que Dalton et d’autres ont réalisées ont montré que les réactions ne sont pas des événements aléatoires ; elles se déroulent selon des formules précises et bien définies. Ce concept important en chimie est abordé plus en détail ci-dessous.
Checkpoint de compréhension
Un élément est constitué de
Certains détails de la théorie atomique de Dalton nécessitent plus d’explications.
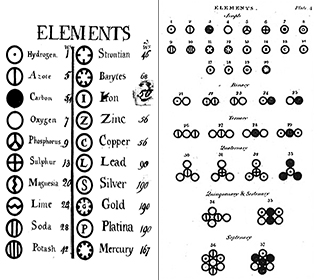
Les éléments : Dès 1660, Robert Boyle a reconnu que la définition grecque de l’élément (terre, feu, air et eau) n’était pas correcte. Boyle a proposé une nouvelle définition de l’élément comme substance fondamentale, et nous définissons maintenant les éléments comme des substances fondamentales qui ne peuvent pas être décomposées davantage par des moyens chimiques. Les éléments sont les blocs de construction de l’univers. Ce sont des substances pures qui forment la base de tous les matériaux qui nous entourent. Certains éléments sont visibles à l’état pur, comme le mercure dans un thermomètre, tandis que d’autres sont principalement présents dans des combinaisons chimiques, comme l’oxygène et l’hydrogène dans l’eau. Nous connaissons aujourd’hui environ 116 éléments différents. Chacun de ces éléments porte un nom et une abréviation d’une ou deux lettres. Souvent, cette abréviation est simplement la première lettre de l’élément ; par exemple, l’hydrogène est abrégé en H, et l’oxygène en O. Parfois, un élément est abrégé en deux lettres ; par exemple, l’hélium est He. Lorsqu’on écrit l’abréviation d’un élément, la première lettre est toujours en majuscule et la deuxième lettre (s’il y en a une) est toujours en minuscule.
Atomes : Une seule unité d’un élément est appelée atome. L’atome est l’unité la plus fondamentale de la matière, qui compose tout ce qui nous entoure. Chaque atome conserve toutes les propriétés chimiques et physiques de son élément parent. À la fin du XIXe siècle, les scientifiques allaient montrer que les atomes étaient en fait constitués de morceaux plus petits, » subatomiques « , ce qui a fait voler en éclats le concept de boule de billard de l’atome (voir notre module Théorie atomique I : les premiers jours).
Les composés : La plupart des matériaux avec lesquels nous entrons en contact sont des composés, des substances formées par la combinaison chimique de deux ou plusieurs atomes des éléments. Une seule « particule » d’un composé s’appelle une molécule. Dalton imaginait à tort que les atomes « s’accrochaient » entre eux pour former des molécules. Cependant, Dalton s’est correctement rendu compte que les composés ont des formules précises. L’eau, par exemple, est toujours composée de deux parties d’hydrogène et d’une partie d’oxygène. La formule chimique d’un composé s’écrit en énumérant les symboles des éléments ensemble, sans espace entre eux. Si une molécule contient plus d’un atome d’un élément, un nombre est inscrit en indice après le symbole pour indiquer le nombre d’atomes de cet élément dans la molécule. Ainsi, la formule de l’eau est H2O, jamais HO ou H2O2.
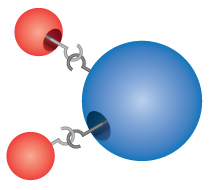
Comprehension Checkpoint
The formula for water can be written as either H2O or HO2.