Principes de biologie
Après avoir appris que les réactions chimiques libèrent de l’énergie lorsque des liaisons stockant de l’énergie sont rompues, une prochaine question importante est la suivante : Comment l’énergie associée à ces réactions chimiques est-elle quantifiée et exprimée ? Comment l’énergie libérée par une réaction peut-elle être comparée à celle d’une autre réaction ? Une mesure de l’énergie libre est utilisée pour quantifier ces transferts d’énergie. Rappelons que selon la deuxième loi de la thermodynamique, tous les transferts d’énergie impliquent la perte d’une certaine quantité d’énergie sous une forme inutilisable telle que la chaleur. L’énergie libre désigne spécifiquement l’énergie associée à une réaction chimique qui est disponible une fois les pertes prises en compte. En d’autres termes, l’énergie libre est une énergie utilisable, ou une énergie disponible pour effectuer un travail. Si l’on considère ce concept sous l’angle biologique, l’énergie libre est l’énergie contenue dans une molécule qui peut être utilisée pour effectuer un travail. Le glucose a beaucoup d’énergie libre parce qu’il y a beaucoup d’énergie stockée dans les liaisons de la molécule de glucose. Le dioxyde de carbone a une énergie libre beaucoup plus faible parce qu’il y a beaucoup moins d’énergie stockée dans ses liaisons.
Si de l’énergie est libérée pendant une réaction chimique, alors le changement d’énergie libre provenant de la conversion des réactifs en produits, signifié par ΔG (delta G) sera un nombre négatif. Une variation négative de l’énergie libre signifie également que les produits de la réaction ont moins d’énergie libre que les réactifs, car ils libèrent de l’énergie libre pendant la réaction. Les réactions qui présentent une variation négative de l’énergie libre et libèrent par conséquent de l’énergie libre sont appelées réactions exergoniques. Pensez-y : exergonique signifie que l’énergie sort du système. Ces réactions sont également appelées réactions spontanées, et leurs produits ont moins d’énergie stockée que les réactifs. Il faut faire une distinction importante entre le terme spontané et l’idée qu’une réaction chimique se produit immédiatement. Contrairement à l’usage courant du terme, une réaction spontanée n’est pas une réaction qui se produit soudainement ou rapidement. La rouille du fer est un exemple de réaction spontanée qui se produit lentement, petit à petit, au fil du temps.
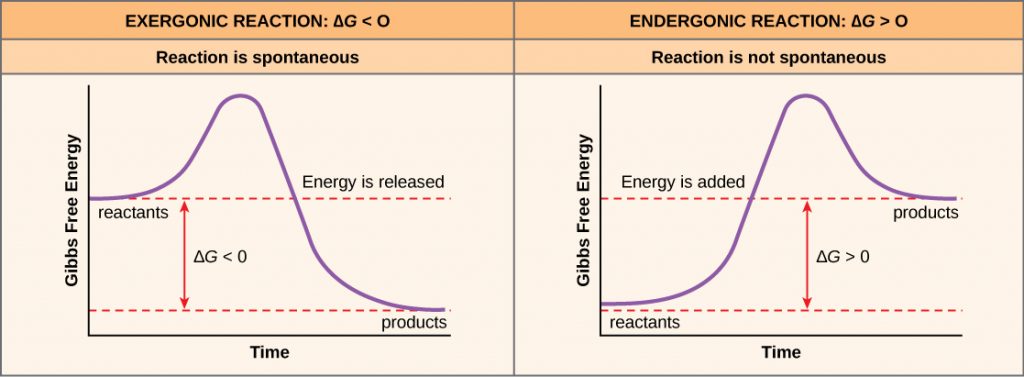
Si une réaction chimique absorbe de l’énergie plutôt que d’en libérer à l’équilibre, alors le ΔG de cette réaction sera une valeur positive. Dans ce cas, les produits ont plus d’énergie libre que les réactifs. Ainsi, les produits de ces réactions peuvent être considérés comme des molécules stockant de l’énergie. Ces réactions chimiques sont appelées réactions endergoniques et elles ne sont pas spontanées.
Une réaction endergonique ne se produira pas d’elle-même sans l’ajout d’énergie libre.

Il y a un autre concept important à prendre en compte concernant les réactions endergoniques et exergoniques. Les réactions exergoniques nécessitent un petit apport d’énergie pour démarrer, avant de pouvoir procéder à leurs étapes de libération d’énergie.
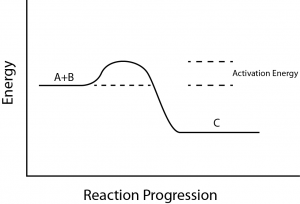
Ces réactions ont une libération nette d’énergie, mais nécessitent tout de même un certain apport d’énergie au début. Cette petite quantité d’apport énergétique nécessaire pour que toutes les réactions chimiques se produisent est appelée énergie d’activation (figure 3).
Sauf mention contraire, les images de cette page sont sous licence CC-BY 4.0 par OpenStax.
Texte adapté de : OpenStax, Concepts de biologie. OpenStax CNX. 18 mai 2016 http://cnx.org/contents/[email protected]
.